题目内容
【题目】多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
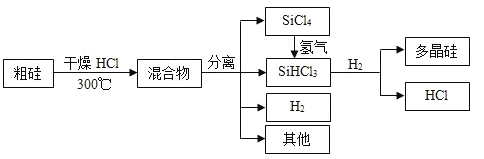
回答下列问题:
Ⅰ.硅粉与![]() 在300℃时反应生成
在300℃时反应生成![]() 气体和
气体和![]() ,放出
,放出![]() 热量,该反应的热化学方程式为_____________。
热量,该反应的热化学方程式为_____________。![]() 的电子式为__________________。
的电子式为__________________。
Ⅱ.将![]() 氢化为
氢化为![]() 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:
①![]()
![]()
②![]()
![]()
③![]()
![]()
(1)氢化过程中所需![]() 高纯度
高纯度![]() 可用惰性电极电解
可用惰性电极电解![]() 溶液制备,写出产生
溶液制备,写出产生![]() 的电极名称______(填“阳极”或“阴极”),该电极反应方程式为_______________。
的电极名称______(填“阳极”或“阴极”),该电极反应方程式为_______________。
(2)反应③的![]() _______________(用
_______________(用![]() ,
,![]() 表示)。
表示)。
(3)由粗硅制备多晶硅过程中循环使用的物质除![]() 、
、![]() 和
和![]() 外,还有______(填分子式)。
外,还有______(填分子式)。
【答案】Si(s)+3HCl(g)![]() SiHCl3(g)+H2(g)
SiHCl3(g)+H2(g) ![]() =-225mol-1
=-225mol-1  阴极 2H2O+2e-===H2
阴极 2H2O+2e-===H2![]() +2OH-
+2OH- ![]() HCl、H2
HCl、H2
【解析】
I. 依据热化学方程式与热量之间的关系书写;参考CH4的电子式书写SiHCl3的电子式;
II.(1)依据电解池的工作原理分析;
(2)根据根据盖斯定律分析计算;
(3)结合流程图分析。
I.根据题意,该反应的热化学方程式为Si(s)+3HCl(g) ![]() SiHCl3(g)+H2(g) △H=-225kJ·mol-1; SiHCl3所有原子达稳定状态,其电子式为
SiHCl3(g)+H2(g) △H=-225kJ·mol-1; SiHCl3所有原子达稳定状态,其电子式为 ;
;
答案为Si(s)+3HCl(g) ![]() SiHCl3(g)+H2(g) △H=-225kJ·mol-1;
SiHCl3(g)+H2(g) △H=-225kJ·mol-1; ;
;
II.(1)根据电解原理,阴极上产生H2,即电极反应式为2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-;
答案为阴极:2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-;
(2)根据根据盖斯定律,②-①得到反应③,即△H3=△H2-△H1;
答案为△H2-△H1;
(3)根据流程循环使用的物质有SiCl4、SiHCl3、Si、HCl、H2;
答案为HCl、H2。

【题目】实验室用密度为1.18g/ml,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
实际应量取盐酸体积/ml | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
______________ | ______________ | ______________ |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______________;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是_________________________________,溶液注入容量瓶前需恢复到室温,这是因为______________________________________;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作_______________;若加蒸馏水时不慎超过了刻度_______________;若定容时俯视刻度线___________________。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度_______________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面_____________________。