题目内容
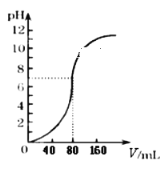
【题目】如图是配制一定物质的量浓度溶液的过程示意图。下列说法中错误的是( )
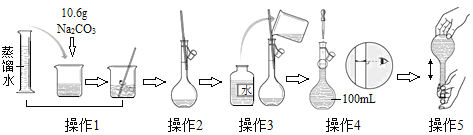
A.所配制的Na2CO3溶液的物质的量浓度为1.0 mol · L-1
B.操作2是将溶解并放置至室温的Na2CO3溶液转移到容量瓶中
C.操作4如果仰视,会使配得溶液的浓度偏低
D.操作5中,定容摇匀后发现液面低于刻度线,继续加水至液面与刻度线相切
【答案】D
【解析】
A选项,10.6g碳酸钠物质的量![]() ,溶液体积为100mL,因此所配制的Na2CO3溶液的物质的量浓度为1.0 molL-1,故A正确,不符合题意;
,溶液体积为100mL,因此所配制的Na2CO3溶液的物质的量浓度为1.0 molL-1,故A正确,不符合题意;
B选项,操作2是将溶解并放置至室温的Na2CO3溶液,冷却至室温后再转移到容量瓶中,故B正确,不符合题意;
C选项,操作4如果仰视,溶液的体积偏大,则配得溶液的浓度偏低,故C正确,不符合题意;
D选项,操作5中,定容摇匀后发现液面低于刻度线,继续加水至液面与刻度线相切,溶液体积偏大,浓度偏低,故D错误,符合题意;
综上所述,答案为D。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 | ||
(1)反应②是_________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图1所示。则平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”)。
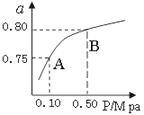
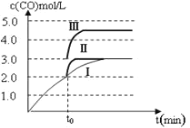
图 1 图2
(3)判断反应③△H____0; △S____0(填“>”“=”或“<”)在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol, 此时v(正)___v(逆)(填“>”“=”或“<”)
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知 c(CO)与反应时间t变化曲线Ⅰ如上图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸.常温条件下,将amol/L的CH3COOH与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________.