题目内容
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
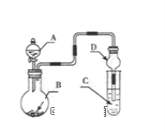
A.若A为浓盐酸,B为Na2SO3,C中盛有Na2SiO3溶液,C中溶液出现白色沉淀,证明酸性:H2SO3> H2SiO3
B.若A为浓盐酸,B为MnO2,C中盛有KI淀粉溶液,C中溶液变蓝色
C.若A为浓氨水,B为生石灰,C中盛有AlCl 3溶液,C中先产生白色沉淀后沉淀溶解
D.若A为H2O2,B为MnO2,C中盛有Na2S溶液,C中溶液变浑浊
【答案】D
【解析】
A、浓盐酸具有挥发性,即产生的SO2中混有HCl,对后续实验产生干扰因此无法证明亚硫酸的酸性强于硅酸,故A不合理;
B、浓盐酸与MnO2反应需要加热,题中所给装置,缺少加热装置,故B不合理;
C、生石灰与水放出热量,有利于NH3的逸出,NH3通入AlCl3溶液中,发生Al3++3NH3·H2O=Al(OH)3↓+3NH4+,继续通入NH3,Al(OH)3不溶于氨水,因此沉淀不溶解,故C不合理;
D、MnO2作催化剂,使H2O2分解:2H2O2![]() 2H2O+O2↑,氧气通入H2S溶液中,将H2S氧化成S单质,即C中溶液变浑浊,故D合理;
2H2O+O2↑,氧气通入H2S溶液中,将H2S氧化成S单质,即C中溶液变浑浊,故D合理;
答案为D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目