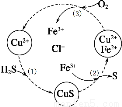
题目内容
20.把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应:3X(气)+Y(气)═nZ(气)+2W(气) 5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/(L•min)求:(1)反应中Z气体的计量数n:1
(2)反应在5分钟末时,Y的转化率:25%
(3)以X浓度变化来表示的反应平均速率为0.03mol/(L•min).
分析 把0.6molX气体和0.4molY气体混合于2L容器中,5min末已生成0.2molW,则:
3X(气)+Y(气)═nZ(气)+2W(气)
起始量(mol):0.6 0.4 0 0
变化量(mol):0.3 0.1 0.1n 0.2
5min末(mol)0.3 0.3 0.1n 0.2
(1)根据速率计算生成Z的物质的量,进而计算n的值;
(2)Y的转化率=$\frac{消耗的Y的物质的量}{Y的起始物质的量}$×100%;
(3)根据v=$\frac{△c}{△t}$计算v(X).
解答 解:把0.6molX气体和0.4molY气体混合于2L容器中,5min末已生成0.2molW,则:
3X(气)+Y(气)═nZ(气)+2W(气)
起始量(mol):0.6 0.4 0 0
变化量(mol):0.3 0.1 0.1n 0.2
5min末(mol)0.3 0.3 0.1n 0.2
(1)0.01mol/(L•min)×5min×2L=0.1n mol,解得n=1,故答案为:1;
(2)Y的转化率=$\frac{0.1mol}{0.4mol}$×100%=25%,故答案为:25%;
(3)v(X)=$\frac{\frac{0.3mol}{2L}}{5min}$=0.03mol/(L•min),故答案为:0.03mol/(L•min).
点评 本题考查化学平衡计算、反应速率计算,比较基础,注意对速率定义式的理解与灵活应用.

练习册系列答案
相关题目
15. 实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:K=$\frac{{C({H_2})C(CO)}}{{C({H_2}O)}}$,该条件下每消耗3g水蒸气,需吸收22kJ的热量,则该反应的热化学反应为:C(s)+H2O(g) CO(g)+H2(g)△H=+132kJ/mol
CO(g)+H2(g)△H=+132kJ/mol
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)平衡常数K1;
CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K3;
则K1、K2、K3之间的关系是:K3=K1×K2.
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是放热反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:75%.
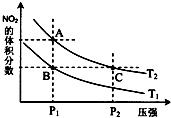
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D.
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)0.2mol/L的NaOH与0.4mol/L的硝酸铵溶液等体积混合后,溶液中各离子的物质的量浓度从大到小的顺序是c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+).
 实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:(1)已知某反应的平衡表达式为:K=$\frac{{C({H_2})C(CO)}}{{C({H_2}O)}}$,该条件下每消耗3g水蒸气,需吸收22kJ的热量,则该反应的热化学反应为:C(s)+H2O(g)
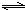 CO(g)+H2(g)△H=+132kJ/mol
CO(g)+H2(g)△H=+132kJ/mol(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)平衡常数K1;
CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K3;
则K1、K2、K3之间的关系是:K3=K1×K2.
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D.
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)0.2mol/L的NaOH与0.4mol/L的硝酸铵溶液等体积混合后,溶液中各离子的物质的量浓度从大到小的顺序是c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+).
12.进入接触室的混和气体体积组成是:SO27%、O211%、N282%.现有100体积混和气体进入接触室,反应后的总体积变为97.2,则SO2的转化率为( )
| A. | 50% | B. | 60% | C. | 80% | D. | 90% |
9.以CO2为碳源制取低碳有机物成为国际研究焦点,CO2加氢可制取乙醇.
(1)H2(g)和CH3CH2OH(l)的燃烧热(△H)分别为-285.8kJ•mol-1和-1365.5kJ•mol-1,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(l)+3H2O(l)△H=-349.3kJ•mol-1
(2)写出反应2CO2(g)+6H2(gC?H3CH2OH(g)+3H2O(g)的平衡常数表达式 K=$\frac{c(C{H}_{3}C{H}_{2}OH)•{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})•{c}^{6}({H}_{2})}$在一定压强下,测得该反应的实验数据如下表.分析表中数据回答下列问题:
其他条件不变,温度升高,K值减小减小(填“增大”、“减小”、或“不变”).其他条件不变,提高氢碳比[n(H2)/n(CO2)],K值不变(填“增大”、“减小”、或“不变”)
(3)在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所1示.
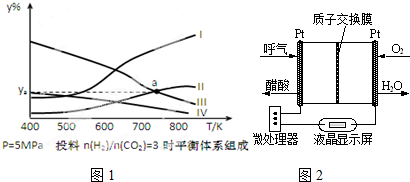
完成下列填空:
①表示CH3CH2OH体积分数曲线的是Ⅳ(选填序号)
②其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是b(选填编号);达到平衡后,能提高H2转化率的操作是ac(选填编号)
a.降低温度 b.充入更多的H2
c.移去乙醇 d.增大容器体积
③图1中曲线Ⅱ和Ⅲ的交点a对应的体积分数ya=18.75%
(4)如图2所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应式为CH3CH2OH+H2O-4e-=CH3COOH+4H+.
(1)H2(g)和CH3CH2OH(l)的燃烧热(△H)分别为-285.8kJ•mol-1和-1365.5kJ•mol-1,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(l)+3H2O(l)△H=-349.3kJ•mol-1
(2)写出反应2CO2(g)+6H2(gC?H3CH2OH(g)+3H2O(g)的平衡常数表达式 K=$\frac{c(C{H}_{3}C{H}_{2}OH)•{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})•{c}^{6}({H}_{2})}$在一定压强下,测得该反应的实验数据如下表.分析表中数据回答下列问题:
| 温度 CO2转化率 $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500K | 600K | 700K | 800K |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
(3)在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所1示.

完成下列填空:
①表示CH3CH2OH体积分数曲线的是Ⅳ(选填序号)
②其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是b(选填编号);达到平衡后,能提高H2转化率的操作是ac(选填编号)
a.降低温度 b.充入更多的H2
c.移去乙醇 d.增大容器体积
③图1中曲线Ⅱ和Ⅲ的交点a对应的体积分数ya=18.75%
(4)如图2所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应式为CH3CH2OH+H2O-4e-=CH3COOH+4H+.
10.有关实验的叙述,正确的是( )
| A. | 用瓷坩埚熔融氢氧化钠或碳酸钠 | |
| B. | 用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH | |
| C. | 读取量筒内液体的体积,俯视读数导致读数偏大 | |
| D. | 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 |