题目内容
【题目】[选修 3——物质结构与性质]
X、Y、Z、W、Q、R 均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:

回答下列问题:
(1)Y 元素的基态原子的电子排布式为 ,其第一电离能比 Z 元素原子的第一电离能 (填“高”或“低”)
(2)X 的氯化物的熔点比 Q 的氯化物的熔点 (填“高”或“低”),理由是
(3)光谱证实元素 W 的单质与强碱性溶液反应有 W(OH)4]-生成,则 W(OH)4]-中存在 (填字母)
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
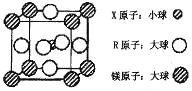
(4)含有 X、R 和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为 ; 晶体中每个镁原子周围距离最近的 R 原子有 个。
【答案】(1)1s22s22p3,高;
(2)低,X的氯化物为分子晶体,Q的氯化物为离子晶体;
(3)ac;(4)MgNi3C,12。
【解析】
试题分析:X 元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同,电子排布式为1s22s22p2,推出X为C,Y 元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 ,推出Y为N,Z元素的族序数是其周期数的三倍,推出Z为O,根据W的原子的电离能,第三电离能到第四电离能发生突变,说明W最外层有3个的电子,因为原子序数增大,即W为Al,Q为前四周期中电负性最小的元素,从左向右电负性增强,即Q为K,元素R位于周期表的第10列,说明R为Ni,(1)根据上述分析,N的基态原子的电子排布式为:1s22s22p3,O的电子排布式是1s22s22p4,根据洪特规则,半满、全满、全空原子处于稳定,因此N的第一电离能比O的第一电离能高;(2)X的氯化物是CCl4,属于分子晶体,Q的氯化物是KCl,属于离子晶体,一般离子晶体熔沸点高于分子晶体;(3)[Al(OH)4]-中H和O以极性共价键形式结合,Al与其中的一个OH-以配位键形式结合,故选项ac正确;(4)根据均摊,X位于晶胞体内,因此晶胞中有1个C,Ni位于六个面上,个数为6×1/2=3,Mg位于顶点,个数为8×1/8=1,因此化学式为MgNi3C,与镁距离最近的Ni原子,位于面上的Ni原子,因此共有12个。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
