题目内容
.(17分)减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (填序号):
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g) CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。

①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO 还原为N2,一段时间后,溶液的碱性
还原为N2,一段时间后,溶液的碱性
明显增强。则该反应离子方程式为 。
②电化学降解NO 的原理如图所示,电源正极为 (填“a”或“b”);
的原理如图所示,电源正极为 (填“a”或“b”);
若总反应为4NO3-+4H+通电5O2↑+2N2↑+2H2O,则阴极反应式为 。

(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (填序号):
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO
 还原为N2,一段时间后,溶液的碱性
还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为 。
②电化学降解NO
 的原理如图所示,电源正极为 (填“a”或“b”);
的原理如图所示,电源正极为 (填“a”或“b”);若总反应为4NO3-+4H+通电5O2↑+2N2↑+2H2O,则阴极反应式为 。

31.(17分)
(1)(4分)① C(s)+H2O(g)= CO(g) +H2(g) ΔH=+131.3kJ·mol-1(2分)
② a c(2分,错1个0分)
(2)(5分)① 5:4(2分) ②KM=KN>KQ(3分。关系式正确1个给2分,全对3分)
(3)(8分)①2 NO3-+5H2催化剂N2+2OH-+4H2O(3分,化学式、系数、条件各1分)
②a(2分) 2 NO3-+12 H++10e-=N2↑+6H2O(3分。化学式、系数、条件各1分。阳极反应为:4OH-—4e-=O2↑+2H2O或10H2O-20e-=20H++5O2↑。)
(1)(4分)① C(s)+H2O(g)= CO(g) +H2(g) ΔH=+131.3kJ·mol-1(2分)
② a c(2分,错1个0分)
(2)(5分)① 5:4(2分) ②KM=KN>KQ(3分。关系式正确1个给2分,全对3分)
(3)(8分)①2 NO3-+5H2催化剂N2+2OH-+4H2O(3分,化学式、系数、条件各1分)
②a(2分) 2 NO3-+12 H++10e-=N2↑+6H2O(3分。化学式、系数、条件各1分。阳极反应为:4OH-—4e-=O2↑+2H2O或10H2O-20e-=20H++5O2↑。)
试题分析: (1)①根据盖斯定律,所求反应的热化学方程式可由已知方程式2-1得,因此焦炭与水蒸气的反应方程式为C(s)+H2O(g)= CO(g) +H2(g) ΔH=+131.3kJ·mol。
②洗涤含SO2的烟气是为了减少空气中SO2的排放,所以洗涤剂必须满足能够和SO2反应,所以选项中能够和SO2反应的试剂有Ca(OH)2 、Na2CO3 ,所以选ac。
(2) ①图中M、N两点平衡状态下,相应的转化率为70%、50%,因此根据反应情况计算
CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)初始(mol):10 20 0
转化(mol):7 14 7
5 10 5
平衡(mol):3 6 7
5 10 5
n(M)总:n(N)总=(3+6+7):(5+10+5)=16:20=4:5
②平衡常数与温度有关,于压强无关,因此M、N2点的温度相同,平衡常数也相等,但是随着温度升高,由于正向CO的转化率下降,因此平衡逆向移动,平衡常数减小,因此有KM=KN>KQ 。
(3)①题中已经说的比较清楚,反应由H2将NO
 还原为N2,且碱性增强,说明该反应是氧化还原反应,有OH-生成,根据氧化还原反应缺项配平,先把发生化合价变化的物质配平,然后原子守恒补上H2O,在电荷守恒配平得2 NO3-+5H2催化剂N2+2OH-+4H2O。
还原为N2,且碱性增强,说明该反应是氧化还原反应,有OH-生成,根据氧化还原反应缺项配平,先把发生化合价变化的物质配平,然后原子守恒补上H2O,在电荷守恒配平得2 NO3-+5H2催化剂N2+2OH-+4H2O。②根据图中所示讲解的硝酸根被还原为了N2逸出,因此右边发生了还原反应,是阴极,b极为电源的负极,而a极是电源正极。根据总反应式,阴极发生的NO3-的还原反应为2 NO3-+12 H++10e-=N2↑+6H2O

练习册系列答案
相关题目
 HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0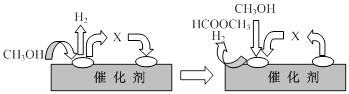






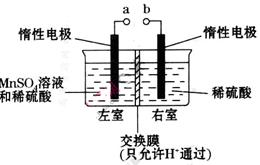
 个,左室溶液中
个,左室溶液中 的变化量为________________。
的变化量为________________。 CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表。
CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表。 2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
2Fe(s)+3CO2(g);△H="-24.8" kJ/mol CO(g)
CO(g) Fe3O4(s)+
Fe3O4(s)+