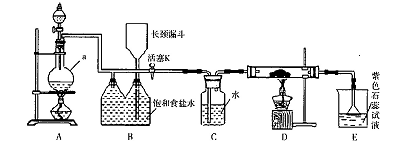
题目内容
下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。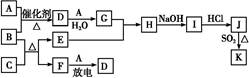
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为 ;F的结构式为 。
(2)A与B反应的化学方程式为 。
(3)E与G的稀溶液反应的离子方程式为 。
(4)B和C反应的化学方程式为 。
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式 。
(1)NO N≡N
(2)4NH3+5O2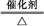 4NO+6H2O
4NO+6H2O
(3)3Cu+8H++2N
 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
(4)3CuO+2NH3 3Cu+N2+3H2O
3Cu+N2+3H2O
(5)2Cu2++2Cl-+SO2+2H2O 2CuCl↓+4H++S
2CuCl↓+4H++S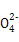
解析

 名校课堂系列答案
名校课堂系列答案硫酸和硝酸是中学阶段常见的两种强酸,请就两者与金属铜的反应情况回答下列问题:
(1)在100 mL 18 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 (填写代号);
| A.7.32 L | B.6.72 L | C.20.16 L | D.30.24 L |
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是 (填序号)
| A.Ba(NO3)2 | B.BaCl2 | C.Ba(OH)2 | D.溶有NH3的BaCl2溶液 |
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
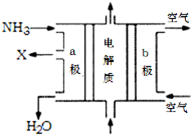
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作 极(填“正”“负”“阴”或“阳”),其电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有 。
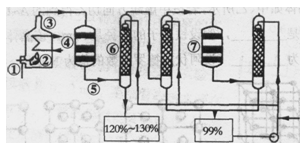
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: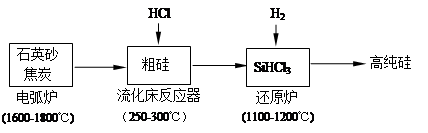
①工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃除生成粗硅外,也可以生产碳化硅,则在电弧炉内可能发生的反应的化学方程式为 。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应方程式 。
(3)有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 ;SiHCl3极易水解,其完全水解的产物为 。
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(4)还原炉中发生的化学反应为: 。
(5)氯碱工业可为上述工艺生产提供部分原料,这些原料是 。