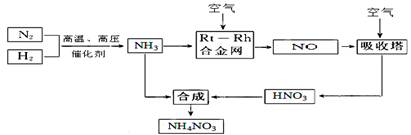
题目内容
工业上制漂白粉的化学方程式为:______________________________________;漂白粉在水中因吸收空气中的CO2而实现漂白的原理:____________________________(用化学方程式表示)
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
解析试题分析: 氯气可以和强碱之间反应生成氯化物、次氯酸盐和水,漂白粉的成分是CaCl2和Ca(ClO)2的混合物。Cl2通入石灰乳制取漂白粉2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,其漂白原理是次氯酸钙与空气中的二氧化碳和水反应生成了次氯酸,故它的漂白原理为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
考点:考查漂白粉制取以及漂白原理的相关知识点。

练习册系列答案
相关题目
能够用于鉴别二氧化碳和二氧化硫的溶液是
| A.澄清石灰水 | B.品红溶液 | C.酸性高锰酸钾溶液 | D.BaCl2溶液 |
下列反应发生时,会产生棕黄色烟的是( )
| A.铁在氯气中燃烧 | B.铜在氯气中燃烧 |
| C.氢气在氯气中燃烧 | D.钠在氯气中燃烧 |
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
| n(SO32﹣):n(HSO3﹣) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如图:

①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理: 。
 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体