题目内容
20.设NA代表阿伏加德罗常数的值,下列说法正确的是( )| A. | 0.1 mol H2O和D2O组成的混合物中含有中子数是NA | |
| B. | 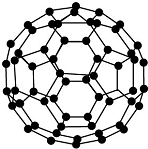 28 g N60(分子结构如图所示)中含有的N-N键数目为1.5NA | |
| C. | 0℃、1.01×105 Pa时,11.2 L氧气中所含的原子数约为NA | |
| D. | 常温下,将5.6 g铁投入足量的稀硫酸中,充分反应,转移电子数为0.3NA |
分析 A、一个H2O分子中含8个中子,一个D2O分子中含10个中子;
B、依据n=$\frac{m}{M}$计算物质的量,结合N60结构是每个氮原子和三个氮原子结合,每两个氮原子间形成一个共价键计算化学键数;
C、标准状况下金属气体物质的量n=$\frac{V}{22.4}$,结合氧气分子式计算得到;
D、铁和稀硫酸反应生成硫酸亚铁和氢气.
解答 解:A、一个H2O分子中含8个中子,一个D2O分子中含10个中子,0.1mol H2O和D2O组成的混合物中含有的中子数小于NA,故A错误;
B、n=$\frac{28g}{14×60g/mol}$=$\frac{1}{30}$mol,N60结构是每个氮原子和三个氮原子结合形成两个双键和一个单键,每两个氮原子间形成一个共价键,1mmolN60含有N-N键=$\frac{60×3}{2}$=30mol,$\frac{1}{30}$molN60含有N-N键1mol,故B错误;
C、0℃、1.0l×105Pa时,11.2L氧气物质的量为0.5mol,所含的原子数为NA,故C正确;
D、铁和稀硫酸反应生成硫酸亚铁和氢气,将5.6g铁物质的量为0.1mol,投入足量的稀硫酸中充分反应,转移电子数为0.2NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
10.下列有关Ksp的叙述中正确的是( )
①Ksp大的电解质,其溶解度一定大
②Ksp只与电解质的本性有关,而与外界条件无关
③Ksp表示难溶电解质在水中达到沉淀溶解平衡时,溶液中离子浓度计量数次幂之积
④Ksp的大小与难溶电解质的性质和温度有关.
①Ksp大的电解质,其溶解度一定大
②Ksp只与电解质的本性有关,而与外界条件无关
③Ksp表示难溶电解质在水中达到沉淀溶解平衡时,溶液中离子浓度计量数次幂之积
④Ksp的大小与难溶电解质的性质和温度有关.
| A. | ①③ | B. | ②④ | C. | ③④ | D. | ①② |
5.2013年3月19日我国宣布研制出“全碳气凝胶”,其密度是0.16mg/cm3,成为已知的最轻固态材料.对这种物质的认识正确的是( )
| A. | 是碳元素的一种同素异形体 | B. | 是碳元素的一种同位素原子 | ||
| C. | 全部由12C组成 | D. | 能溶于水 |
12.下列各组物质中化学键的类型相同的是( )
| A. | HCl、MgCl2、NH4Cl | B. | H2O、Na2O、金刚石 | C. | NaCl、NaOH、H2O | D. | NH3、H2O、CO2 |
 ⑤
⑤ ⑥
⑥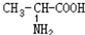 与
与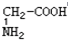
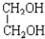 与
与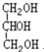 ⑧
⑧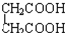 与
与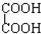 ⑨C3H6与C4H8.
⑨C3H6与C4H8. .
. 、
、 、
、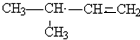 (任意一种);(写出其中的一种)
(任意一种);(写出其中的一种)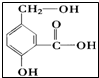 按要求回答下列各题.
按要求回答下列各题.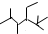 的名称为2,2,4,5-四甲基-3,3-二乙基庚烷.
的名称为2,2,4,5-四甲基-3,3-二乙基庚烷. .
.
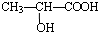 .
.