题目内容
12.下列各组物质中化学键的类型相同的是( )| A. | HCl、MgCl2、NH4Cl | B. | H2O、Na2O、金刚石 | C. | NaCl、NaOH、H2O | D. | NH3、H2O、CO2 |
分析 化学键分为离子键和共价键,离子键为阴阳离子之间的静电作用,共价键为相邻原子之间的较强作用力,从组成上判断,活泼金属与活泼非金属性形成离子键,非金属性原子之间形成共价键.
解答 解:A.HCl只含有共价键,MgCl2和NH4Cl存在离子键,化学键类型不相同,故A错误;
B.H2O和金刚石只含有共价键,Na2O存在离子键,化学键类型不相同,故B错误;
C.NaCl、NaOH为离子化合物,含有离子键,H2O为共价化合物,只含有共价键,化学键类型不相同,故C错误;
D.NH3、H2O、CO2都为共价化合物,只含有共价键,化学键类型相同,故D正确.
故选D.
点评 本题考查化学键类型的判断,题目难度不大,注意共价键和离子键的区别.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
3.下列事实中,能说明苯环对侧链的性质有影响的是( )
| A. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 | |
| B. | 乙醇、苯酚都有羟基,但是电离常数不同 | |
| C. | 苯酚无需催化剂即能与溴水发生取代反应 | |
| D. | 1 mol甲苯能与3 mol H2发生加成反应 |
20.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1 mol H2O和D2O组成的混合物中含有中子数是NA | |
| B. | 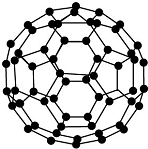 28 g N60(分子结构如图所示)中含有的N-N键数目为1.5NA | |
| C. | 0℃、1.01×105 Pa时,11.2 L氧气中所含的原子数约为NA | |
| D. | 常温下,将5.6 g铁投入足量的稀硫酸中,充分反应,转移电子数为0.3NA |
7.下列元素中,原子半径最大的是( )
| A. | Li | B. | Na | C. | F | D. | S |
17.IIA族元素从第二周期到到第六周期的元素分别是Be(铍)、Mg(镁)、Ca(钙)、Sr(锶)、Ba(钡).下列关于ⅡA族元素预言可能正确的是( )
①常温下,单质铍能与水剧烈反应放出H2
②常温下,单质钡能与水剧烈反应放出H2
③Be(OH)2易溶于水
④Ba(OH)2易溶于水
⑤SrCO3易溶于水.
①常温下,单质铍能与水剧烈反应放出H2
②常温下,单质钡能与水剧烈反应放出H2
③Be(OH)2易溶于水
④Ba(OH)2易溶于水
⑤SrCO3易溶于水.
| A. | ①②③ | B. | ③⑤ | C. | ②④ | D. | ①②③④⑤ |
1.下列各组中互为同位素的是( )
| A. | ${\;}_{19}^{40}$K与${\;}_{20}^{40}$Ca | B. | 3H2O与1H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |




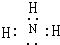 ,实验室制取该氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
,实验室制取该氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O. .
.