题目内容
11.某烃类化合物A,其蒸汽对氢气的相对密度是42,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢.(1)A的结构简式为(CH3)2C=C(CH3)2.
(2)A中的碳原子是否都处于同一平面?是(填“是”或“不是”)).
(3)已知A、B、C有如下转化关系:则反应②的化学方程式为(CH3)2CBrCBr(CH3)2+2NaOH$→_{△}^{乙醇}$CH2=C(CH3)C(CH3)=CH2+2NaBr+2H2O.
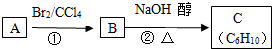
分析 某烃类化合物A,其蒸汽对氢气的相对密度是42,则A的相对分子质量为84,红外光谱表明分子中含有碳碳双键,所以该烃中C原子个数=$\frac{84}{12}$=6…12,分子式为C6H12,核磁共振氢谱表明分子中只有一种类型的氢,则A结构简式为(CH3)2C=C(CH3)2,A和溴发生加成反应生成B,B为(CH3)2CBrCBr(CH3)2,B发生消去反应生成C,C结构简式为CH2=C(CH3)C(CH3)=CH2,据此分析解答.
解答 解:某烃类化合物A,其蒸汽对氢气的相对密度是42,则A的相对分子质量为84,红外光谱表明分子中含有碳碳双键,所以该烃中C原子个数=$\frac{84}{12}$=6…12,分子式为C6H12,核磁共振氢谱表明分子中只有一种类型的氢,则A结构简式为(CH3)2C=C(CH3)2,A和溴发生加成反应生成B,B为(CH3)2CBrCBr(CH3)2,B发生消去反应生成C,C结构简式为CH2=C(CH3)C(CH3)=CH2,
(1)A的结构简式为(CH3)2C=C(CH3)2,故答案为:(CH3)2C=C(CH3)2;
(2)A具有乙烯结构,所以A中的碳原子都处于同一平面,故答案为:是;
(3)B为(CH3)2CBrCBr(CH3)2,B发生消去反应生成C,C结构简式为CH2=C(CH3)C(CH3)=CH2,则反应②的化学方程式为(CH3)2CBrCBr(CH3)2+2NaOH$→_{△}^{乙醇}$CH2=C(CH3)C(CH3)=CH2+2NaBr+2H2O,
故答案为:(CH3)2CBrCBr(CH3)2+2NaOH$→_{△}^{乙醇}$CH2=C(CH3)C(CH3)=CH2+2NaBr+2H2O.
点评 本题考查有机物推断,涉及烯烃、卤代烃之间的转化,明确反应条件及反应类型是解本题关键,注意消去反应断键和成键方式,题目难度不大.

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 稀硝酸和过量的铁屑反应:3 Fe+8H++2 NO3-=3 Fe3++2 NO↑+4 H2O | |
| D. | KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+H2O2+2H+=2H2O+I2 |
| A. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 | |
| B. | 乙醇、苯酚都有羟基,但是电离常数不同 | |
| C. | 苯酚无需催化剂即能与溴水发生取代反应 | |
| D. | 1 mol甲苯能与3 mol H2发生加成反应 |
| A. | 0.1 mol H2O和D2O组成的混合物中含有中子数是NA | |
| B. | 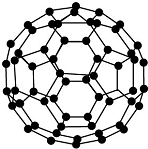 28 g N60(分子结构如图所示)中含有的N-N键数目为1.5NA | |
| C. | 0℃、1.01×105 Pa时,11.2 L氧气中所含的原子数约为NA | |
| D. | 常温下,将5.6 g铁投入足量的稀硫酸中,充分反应,转移电子数为0.3NA |
| A. | ${\;}_{19}^{40}$K与${\;}_{20}^{40}$Ca | B. | 3H2O与1H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |


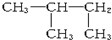



 ,其合成过程中涉及的反应类型分别是( )
,其合成过程中涉及的反应类型分别是( )