题目内容
9.Co(NH3)5BrSO4可形成两种钴的配合物,已知两种配合物的化学式分别为[Co(NH3)5Br]SO4 和[Co (SO4) (NH3)5]Br,在第一种配合物的溶液中加BaCl2 溶液时,现象是白色沉淀生成;如果在第二种配合物的溶液中加入BaCl2溶液时,现象为无明显现象;若加入 AgNO3溶液时,现象为产生淡黄色沉淀.分析 [Co(NH3)5Br]SO4中外界是SO4 2-,[Co(SO4)(NH3)5]Br中外界是Br-,配合物在水溶液中外界能以自由离子形式存在,硫酸根离子能和钡离子反应生成硫酸钡白色沉淀,溴离子能和银离子反应生成淡黄色沉淀AgBr.
解答 解:由[Co(NH3)5Br]SO4可知,SO4 2-为配合物的外界,在水溶液中以离子形式存在,所以会与Ba 2+结合成白色沉淀,[Co(SO4)(NH3)5]Br中SO4 2-为內界,在水溶液里不能以离子存在,所以加入BaCl2溶液时无明显现象,但该物质中Br-为配合物的外界,能和Ag+反应生成淡黄色AgBr沉淀,
所以看到的现象分别是有白色沉淀生成、无明显现象、有淡黄色沉淀生成,
故答案为:白色沉淀生成;无明显现象;产生淡黄色沉淀.
点评 本题考查配合物的成键情况,明确配合物中內界、外界及其外界性质是解本题关键,注意配合物中內界和外界在水溶液中存在方式,题目难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
20.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1 mol H2O和D2O组成的混合物中含有中子数是NA | |
| B. | 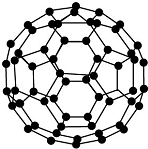 28 g N60(分子结构如图所示)中含有的N-N键数目为1.5NA | |
| C. | 0℃、1.01×105 Pa时,11.2 L氧气中所含的原子数约为NA | |
| D. | 常温下,将5.6 g铁投入足量的稀硫酸中,充分反应,转移电子数为0.3NA |
17.IIA族元素从第二周期到到第六周期的元素分别是Be(铍)、Mg(镁)、Ca(钙)、Sr(锶)、Ba(钡).下列关于ⅡA族元素预言可能正确的是( )
①常温下,单质铍能与水剧烈反应放出H2
②常温下,单质钡能与水剧烈反应放出H2
③Be(OH)2易溶于水
④Ba(OH)2易溶于水
⑤SrCO3易溶于水.
①常温下,单质铍能与水剧烈反应放出H2
②常温下,单质钡能与水剧烈反应放出H2
③Be(OH)2易溶于水
④Ba(OH)2易溶于水
⑤SrCO3易溶于水.
| A. | ①②③ | B. | ③⑤ | C. | ②④ | D. | ①②③④⑤ |
14.下列含氧酸中,酸性最弱的是( )
| A. | HClO | B. | HNO2 | C. | H2SO4 | D. | HIO4 |
1.下列各组中互为同位素的是( )
| A. | ${\;}_{19}^{40}$K与${\;}_{20}^{40}$Ca | B. | 3H2O与1H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |
18.下列离子方程式正确的是( )
| A. | 稀硫酸加入氢氧化钡溶液中:H++OH-=H2O | |
| B. | 铜片上滴加稀硝酸:3Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O | |
| C. | 石灰石投入到稀盐酸中:CO32-+2 H+=CO2↑+H2O | |
| D. | Fe 粉加入稀盐酸中:2 Fe+6 H+=2 Fe3++3 H2↑ |
 ,其合成过程中涉及的反应类型分别是( )
,其合成过程中涉及的反应类型分别是( )
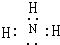 ,实验室制取该氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
,实验室制取该氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O. .
.