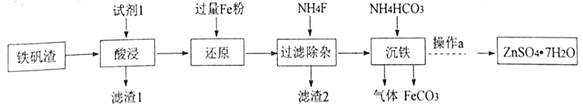
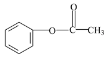
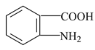
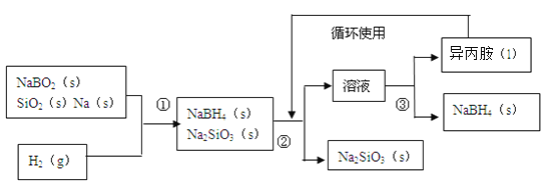
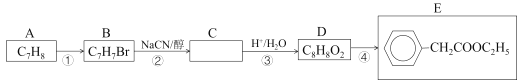
题目内容
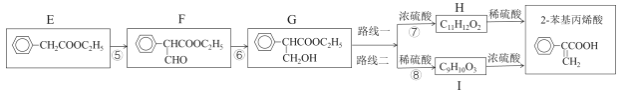
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6kJ·mol-1
2NH3(g)△H=-38.6kJ·mol-1
C.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ·mol-1
【答案】D
【解析】
燃烧热指在25C°、101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量;稀溶液中,酸跟碱发生中和反应生成1 mol液态水时所释放的热量叫做中和热,据此回答问题。
A.甲烷的燃烧热为890.3kJ·mol-1,要生成液态水,甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1,A错误;
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,由于反应为可逆反应,则1molN2完全反应放热大于38.6kJ,其热化学反应方程式为:N2(g)+3H2(g)2NH3(g)△H<-38.6 kJ/mol,B错误;
C.中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量,其衡量标准是生成的水为1mol,故无论稀H2SO4和Ca(OH)2反应生成的水是几摩尔,其中和热恒为57.3kJ/mol,C错误;
D.在101kPa时,2gH2的物质的量为1mol,完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ·mol-1,D正确;
答案为D。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案【题目】I.化合物X含有三种元素,其中两种为非金属元素,且原子个数比为1:1,X不溶于水,能溶于强酸。某研究小组为探究其组成和性质,设计并完成了如下实验。
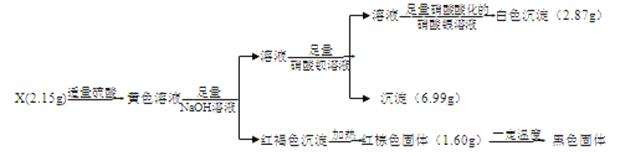
(1)X的化学式是____________________。
(2)写出检验黄色溶液中金属阳离子的实验操作:__________。
(3)黄色溶液中加入铜片,铜片表面被腐蚀,则对应的离子方程式是:_____________________。
II.已知黑色固体中不含单质。为进一步探究其组成,研究小组将上述所得固体全部溶于稀盐酸,配成100mL溶液,每次取20.00mL待测液于锥形瓶中,用2.000×10-2molL-1 KMnO4标准溶液进行滴定,并记录实验的结果如下表:
组次 | 1 | 2 | 3 | 4 |
V标(mL) | 20.00 | 20.02 | 19.99 | 19.99 |
(4)如何判断滴定终点:__________________。
(5)待测液中c(Fe2+) = ____________________。
(6)该黑色固体的化学式用FexOy形式可表示为_______________。