题目内容
【题目】NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如下:
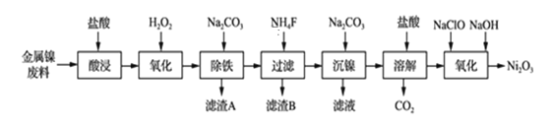
流程中相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③_______________等。
(2)加入H2O2的目的是____________,所发生的离子方程式为____________________。
(3)“除铁”时,控制溶液pH的范围为_____________________。
(4)滤渣B的主要成分的化学式为___________________,滤液中的阳离子有________。
(5)“氧化”生成Ni2O3的离子方程式为________________。
【答案】增大盐酸的浓度(或将镍废料研成粉末或延长浸泡时间等) Fe2+转化成Fe3+ 2Fe2++H2O2+2H+===2Fe3++2H2O 3.2~7.1 MgF2、CaF2 NH4+、Na+ 2Ni2++ClO-+4OH-===Ni2O3↓+Cl-+2H2O
【解析】
根据工艺流程分析可知,向金属镍废料中加入盐酸酸浸,形成Ni2+、Fe2+、Ca2+和Mg2+的溶液,再向溶液中加入H2O2将Fe2+氧化成Fe3+,加入Na2CO3溶液调节pH使得Fe3+沉淀,得到滤渣A为Fe(OH)3,再加入NH4F使得Mg2+和Ca2+沉淀,得到滤渣B为CaF2和MgF2,继续向滤液中加入Na2CO3沉镍,再加入盐酸溶解,向溶液中加入NaClO和NaOH氧化得到Ni2O3,据此分析解答问题。
(1)为了提高金属镍废料浸出的速率,还可以增大盐酸的浓度(或将镍废料研成粉末或延长浸泡时间等),故答案为:增大盐酸的浓度(或将镍废料研成粉末或延长浸泡时间等);
(2)根据上述分析,加入H2O2的目的是将Fe2+氧化成Fe3+,根据氧化还原反应规律得出其离子反应方程式为2Fe2++H2O2+2H+===2Fe3++2H2O,故答案为:Fe2+转化成Fe3+;2Fe2++H2O2+2H+===2Fe3++2H2O;
(3)沉镍前要将Fe3+沉淀完全,而镍离子不能产生沉淀,根据表中所给信息可知,Fe3+完全沉淀的pH值为3.2,镍离子开始沉淀的pH值为7.1,所以溶液的pH值控制在3.2~7.1,故答案为:3.2~7.1;
(4)根据以上分析可知,滤渣B的主要成分的化学式为MgF2、CaF2,所得的滤液中主要含有NH4+和Na+,故答案为:MgF2、CaF2;NH4+、Na+;
(5)“氧化”过程发生的反应中,Cl元素由+1价降低到-1价,即反应生成NaCl,而Ni由+2价升高到+3价,生成Ni2O3,反应离子方程式为:2Ni2++ClO-+4OH-===Ni2O3↓+Cl-+2H2O,故答案为:2Ni2++ClO-+4OH-===Ni2O3↓+Cl-+2H2O。