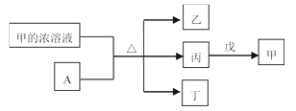
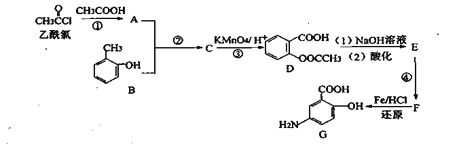
��Ŀ����
����Ŀ��(1)��ʯī ���ռ� ��ʯ��ˮ ���Ȼ��ƾ��� ������ �ް��� ������ ������ ��Һ̬�Ȼ��� ��������Һ�����������ܵ������______�����ڵ���ʵ���_______�����ڷǵ���ʵ���________�������ţ�
(2)��Ҫ��д�����з���ʽ��
��С�մ�����θ���������ӷ���ʽ��____________________��
��������������Һ�м������Ƭ���ӷ���ʽ��__________________��
(3)��Ҫ����л�ѧ���㣺
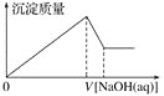
��0.5molij����A��������40 g��A����Է�������Ϊ__________________��
����ͬ��ͬѹͬ����������£�H2������A������֮����1��8����A��Ħ������Ϊ_____________��
��2KMnO4+16HCl(Ũ) =2KCl+2MnCl2+5Cl2��+8H2O���÷�Ӧ�������뻹ԭ�������ʵ���֮��Ϊ________��
��98%��ŨH2SO4(��=1.84 g/cm3)���ʵ���Ũ��Ϊ__________��
����ͬ���ʵ���Ũ�ȵ�NaCl��MgCl2��AlCl3��Һ���ֱ���������AgNO3��Һ��Ӧ�������ɵ�AgCl������ͬʱ�����ĵ�������Һ�������Ϊ______________��
���𰸡��٢ۢݢ� �ڢܢ� �ޢ� HCO3-+H+=H2O+CO2�� 2Al+2OH-+2H2O=2AlO2-+3H2�� 80 16g/mol 1��5 18.4mol/L 6��3��2
��������
(1)���������ƶ��ĵ��ӻ������ƶ�������ʱ�ܹ����磻��ˮ��Һ�л��ۻ�״̬���ܵ���Ļ��������ڵ���ʣ���ˮ��Һ�к��ۻ�״̬���ܲ��ܵ���Ļ��������ڷǵ���ʣ�
(2)��С�մ���̼�����ƣ������ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��ˮ�����������ӷ�Ӧ��Ӧ������ѧʽ��
��Al��NaOH��Һ������Ӧ����ƫ�����ƺ�������
(3)�ٸ���Ħ��������g/molΪ��λʱ����ֵ�ϵ�����Է����������㣻
�ڰ����ӵ�����ȷ������ķ�������ȣ����n=![]() ��n=
��n=![]() ���㣻
���㣻
�۸�����������õ��ӣ�Ԫ�ػ��ϼ۽��ͣ���ԭ��ʧȥ���ӣ�Ԫ�ػ��ϼ����߷����жϣ�
�ܸ������ʵ���Ũ����������������ʽ���������ʵ���Ũ�ȣ�
�ݸ��ݷ�ӦAg++Cl-=AgCl��������AgNO3�����ʵ�����ȣ���NaC1��MgCl2��A1Cl3������Һ��Cl-�����ʵ�����ȣ����ݺ��������������ʽ���㡣
(1)��ʯī�д��������ƶ��ĵ��ӣ��ܵ��磬��ʯ��ˮ�������ᡢ��������Һ�д��������ƶ������ӣ��ܵ��磬�����������ܵ�����Ǣ٢ۢݢ⣻
���ռ���Ȼ��ƾ��塢��Һ̬�Ȼ�����ˮ��Һ�л��ۻ�״̬���ܵ���Ļ������ڢܢ����ڵ���ʣ�
�ް�����ˮ��Ӧ������һˮ�ϰ����ֵ�������ӣ��ܹ����磬�������������ܷ������룬�����磬�������ڷǵ���ʣ���������ˮ��Һ������״̬�¶���������������������ƶ����������磬���ڷǵ���ʣ����ޢ����ڷǵ���ʣ�
(2)��̼�����������ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼�������ӷ�ӦΪH++HCO3-=CO2��+H2O��
��Al��NaOH��Һ������Ӧ����ƫ�����ƺ���������Ӧ�����ӷ���ʽΪ��2Al+2H2O+2OH-=2AlO2-+3H2����
(3)��0.5molij����A��������40 g����A��Ħ������M=![]() =80g/mol������Ħ����������g/molΪ��λ����ֵ�ϵ��ڸ����ʵ���Է�������������A����Է�������Ϊ80��
=80g/mol������Ħ����������g/molΪ��λ����ֵ�ϵ��ڸ����ʵ���Է�������������A����Է�������Ϊ80��
�ڸ��ݰ����ӵ����ɿ�֪����ͬ��ͬѹ�£���ͬ������κ�����ķ�������ͬ����n=![]() ��֪������������ʵ�����ȣ������n=
��֪������������ʵ�����ȣ������n=![]() ��֪���������Ħ�������ȵ������������֮�ȣ�H2������A������֮����1��8������M(H2)��M(A)= 1��8��M(H2)=2g/mol������M(A)=16g/mol��
��֪���������Ħ�������ȵ������������֮�ȣ�H2������A������֮����1��8������M(H2)��M(A)= 1��8��M(H2)=2g/mol������M(A)=16g/mol��
���ڷ�Ӧ2KMnO4+16HCl(Ũ) =2KCl+2MnCl2+5Cl2��+8H2O�У�MnԪ�صĻ��ϼ��ɷ�ӦǰKMnO4�е�+7�۱�Ϊ��Ӧ��MnCl2�е�+2�ۣ����ϼ۽��ͣ����Ը÷�Ӧ��������KMnO4��ClԪ�صĻ��ϼ��ɷ�ӦǰHCl�е�-1�۱�Ϊ��Ӧ��Cl2�е�0�ۣ����ϼ����ߣ�ʧȥ���ӣ����Ը÷�Ӧ�Ļ�ԭ����HCl���������뻹ԭ�������ʵ���֮��Ϊ2��10=1��5��
�ܸ������ʵ���Ũ����������������ʽ�ɼ�����������ʵ���Ũ��c=![]() mol/L=18.4mol/L��
mol/L=18.4mol/L��
�����������ʵ���Һ�ж�������ӦAg++Cl-=AgCl��������AgNO3�����ʵ�����ȣ����Ũ�ȵ�NaC1��MgCl2��A1Cl3������Һ��Cl-�����ʵ�����ȣ�����Cl-�����ʵ�������6mol��NaC1��MgCl2��A1Cl3������ҺŨ�ȶ���1mol/L������Ҫ������Һ�����V(NaCl)= ![]() =6L��V(MgCl2)=
=6L��V(MgCl2)= ![]() =3L��V(AlCl3)=
=3L��V(AlCl3)= ![]() =2L������V(NaCl)��V(MgCl2)��V(AlCl3)= 6��3��2��
=2L������V(NaCl)��V(MgCl2)��V(AlCl3)= 6��3��2��

 ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�