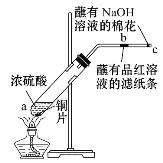
题目内容
【题目】天青石主要用于制造碳酸锶(SrCO3)以及生产电视机显像管玻璃等,其主要成分是SrSO4,还含有少量BaSO4。测定天青石中钡元素的含量可采用以下方法。

已知:①EDTA可与Sr2+、Cu2+形成配合物;
②BaCrO4在盐酸中溶解,产生Cr2O72-;
③2Na2S2O3+I2=Na2S4O6+2NaI;
④Ksp(CuS)=3.4×10-36。
(1)高温焙烧时SrSO4和BaSO4被过量的焦炭还原为可溶性的SrS和BaS,写出SrSO4与焦炭反应的化学反应方程式________,BaS的电子式为________。
(2)加入EDTA的目的是________________。
(3)过程③的离子反应方程式________________。
(4)若过程①和过程②未将洗涤液与滤液合并会导致测定Ba的含量________(填“偏大”“偏小”或“无影响”)。
(5)滴定时以________为指示剂,滴定终点观察到的现象________。
(6)加入CuCl2,目的是将溶液中的S2-沉淀完全,当溶液中c(Cu2+)为0.1mol/L时,溶液中c(S2-)的浓度为________。
(7)该天青石中钡的质量分数为________%(保留一位小数)。
【答案】SrSO4+4C![]() SrS+4CO↑
SrS+4CO↑ ![]()
![]() EDTA与Sr2+、Cu2+形成配合物,避免加入K2Cr2O7形成沉淀引起误差 Cr2O72-+2Ba2++H2O=2BaCrO4↓+2H+ 偏小 淀粉溶液 溶液由蓝色变为无色,且半分钟不恢复 3.4×10-35 0.5%
EDTA与Sr2+、Cu2+形成配合物,避免加入K2Cr2O7形成沉淀引起误差 Cr2O72-+2Ba2++H2O=2BaCrO4↓+2H+ 偏小 淀粉溶液 溶液由蓝色变为无色,且半分钟不恢复 3.4×10-35 0.5%
【解析】
天青石与焦炭在高温焙烧的条件下,生成SrS、BaS;加入CuCl2溶液时,Cu2+与溶液中的S2-生成CuS沉淀;EDTA可与Sr2+、Cu2+形成配合物,可防止加入K2Cr2O7形成沉淀引起误差;溶液中的Ba2+与Cr2O72-发生反应生成BaCrO4;加入盐酸溶解并产生Cr2O72-;再与碘离子反应生成单质碘;再用硫酸硫酸钠滴定碘单质,测定含量。
(1)已知高温焙烧时SrSO4被过量的焦炭还原为可溶性的SrS,则反应的方程式为SrSO4+4C![]() SrS+4CO↑,BaS为离子化合物,其电子式为
SrS+4CO↑,BaS为离子化合物,其电子式为![]()
![]() 。
。
(2)已知EDTA可与Sr2+、Cu2+形成配合物,加入EDTA的目的是EDTA与Sr2+、Cu2+形成配合物,避免加入K2Cr2O7形成沉淀引起误差。
(3)过程③中加入K2Cr2O7后产生BaCrO4,K2Cr2O7和BaCrO4中Cr的化合价均为![]() 价,此反应为非氧化还原反应,据此可写出反应方程式:Cr2O72-+2Ba2++H2O=2BaCrO4↓+2H+。
价,此反应为非氧化还原反应,据此可写出反应方程式:Cr2O72-+2Ba2++H2O=2BaCrO4↓+2H+。
(4)若过程①和过程②未将洗涤液与滤液合并会使Ba2+损失而造成测定结果偏小。
(5)根据BaCrO4加盐酸产生了Cr2O72-加入Na2S2O3发生反应为2Na2S2O3+I2=Na2S4O6+2NaI,可知Cr2O72-氧化碘离子变为碘单质,再用Na2S2O3滴定I2,故指示剂可选用淀粉指示溶液中I2的量来判断终点,终点变色即为由蓝色变为无色,且半分钟不恢复。
(6)根据Ksp(CuS)=3.4×10-36,将c(Cu2+)为0.1mol/L带入式子即可求得c(S2-)的浓度为3.4×10-35。
(7)Cr2O72-+2Ba2++H2O=2BaCrO4↓+2H+,Cr2O72-+6I-+14H+=2Cr3++7H2O+3I2,2Na2S2O3+I2=Na2S4O6+2NaI,可知n(Na2S2O3)=![]() n(I2)=
n(I2)=![]() n(Cr2O72-)=
n(Cr2O72-)=![]() n(Ba2+),m(Ba)=
n(Ba2+),m(Ba)=![]() cV×M(Ba),
cV×M(Ba),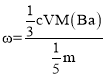 ,代数可得0.5%。
,代数可得0.5%。

 阅读快车系列答案
阅读快车系列答案【题目】用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下:
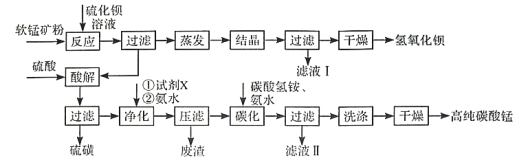
已知:MnO2是一种两性氧化物;25℃时相关物质的Ksp见下表。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp |
|
|
|
|
回答下列问题
(1)软锰矿预先粉碎的目的是____________,MnO2与BaS溶液反应转化为MnO的化学方程式为________。
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是________。
(3)滤液I可循环使用,应当将其导入到________操作中(填操作单元的名称)。
(4)净化时需先加入的试剂X为________(填化学式)。再使用氨水调溶液的pH,则pH的理论最小值为_______(当溶液中某离子浓度![]() 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为______________________。
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:

(1)元素d基态原子包含____种运动状态不同的电子,这些电子位于____种能量不同的原子轨道中。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____。
(3)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是_____。
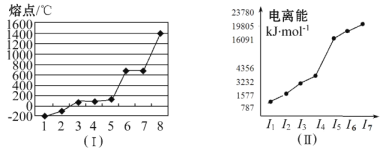
(4)第3周期8种元素按单质熔点高低的顺序如图(Ⅰ)所示,其中电负性最大的是____(填I图中的序号)。表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是_____(填元素名称)。
(5)a、d、l三种元素可形成一种离子化合物,其中的化学键类型除了离子键,还包括____。