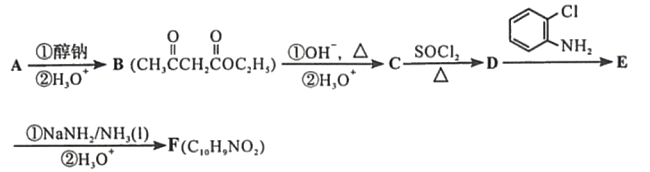
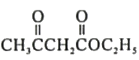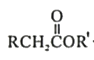题目内容
【题目】探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ. ![]()
![]()
Ⅱ. ![]()
![]()
Ⅲ. ![]()
![]()
回答下列问题:
(1)![]() _________
_________![]() 。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为__________mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
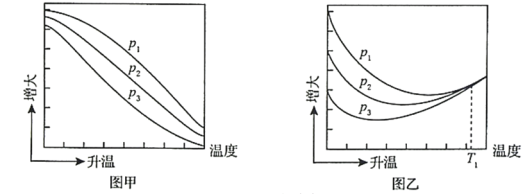
已知:CO2的平衡转化率=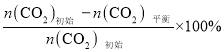
CH3OH的平衡产率=![]()
其中纵坐标表示CO2平衡转化率的是图___________(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________;图乙中T1温度时,三条曲线几乎交于一点的原因是___________。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_________(填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
【答案】+40.9 ![]()
![]() 乙 p1、p2、p3 T1时以反应Ⅲ为主,反应Ⅲ前后气体分子数相等,压强改变对平衡没有影响 A
乙 p1、p2、p3 T1时以反应Ⅲ为主,反应Ⅲ前后气体分子数相等,压强改变对平衡没有影响 A
【解析】
根据盖斯定律计算反应热;利用三个反应,进行浓度和化学平衡常数的计算;结合图形根据勒夏特列原理考虑平衡移动的方向,确定温度和压强变化时,CO2的平衡转化率和CH3OH的平衡产率之间的关系得到相应的答案。
(1).根据反应I+II=III,则△H3=△H1+△H2=-49.5kJmol-1+(-90.4 kJmol-1)=+40.9 kJmol-1;
(2).假设反应II中,CO反应了xmol,则II生成的CH3OH为xmol,I生成的CH3OH为(a-x)mol,III生成CO为(b+x)mol,根据反应I: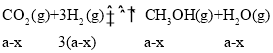 ,反应II:
,反应II: 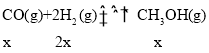 ,反应III:
,反应III: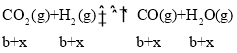 ,所以平衡时水的物质的量为(a-x)mol+(b+x)mol =(a+b)mol,浓度为:
,所以平衡时水的物质的量为(a-x)mol+(b+x)mol =(a+b)mol,浓度为:![]() ;平衡时CO2的物质的量为1mol-(a-x)mol-(b+x)mol=(1-a-b)mol,H2的物质的量为3mol-3(a-x)mol-2x-(b+x)mol=(3-3a-b)mol,CO的物质的量为bmol,水的物质的量为(a+b)mol,则反应III的平衡常数为:
;平衡时CO2的物质的量为1mol-(a-x)mol-(b+x)mol=(1-a-b)mol,H2的物质的量为3mol-3(a-x)mol-2x-(b+x)mol=(3-3a-b)mol,CO的物质的量为bmol,水的物质的量为(a+b)mol,则反应III的平衡常数为: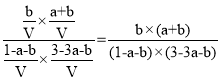 ;
;
(3).反应I和II为放热反应,升高温度,平衡逆向移动,则CH3OH的平衡产率减少,所以图甲表示CH3OH的平衡产率,图乙中,开始升高温度,由于反应I和II为放热反应,升高温度,平衡逆向移动,CO2的平衡转化率降低,反应III为吸热反应,升高温度反应III向正反应方向移动,升高一定温度后以反应III为主,CO2的平衡转化率又升高,所以图乙表示CO2的平衡转化率;压强增大,反应I和II是气体体积减小的反应,反应I和II平衡正向移动,反应III气体体积不变化,平衡不移动,故压强增大CH3OH的平衡产率增大,根据图所以压强关系为:p1>p2>p3;温度升高,反应I和II平衡逆向移动,反应III向正反应方向移动,所以T1温度时,三条曲线交与一点的原因为:T1时以反应III为主,反应III前后分子数相等,压强改变对平衡没有影响;
(4).根据图示可知,温度越低,CO2的平衡转化率越大,CH3OH的平衡产率越大,压强越大,CO2的平衡转化率越大,CH3OH的平衡产率越大,所以选择低温和高压,答案选A。

 应用题作业本系列答案
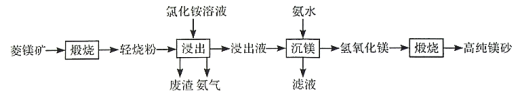
应用题作业本系列答案【题目】用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下:
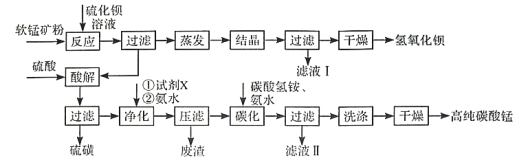
已知:MnO2是一种两性氧化物;25℃时相关物质的Ksp见下表。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp |
|
|
|
|
回答下列问题
(1)软锰矿预先粉碎的目的是____________,MnO2与BaS溶液反应转化为MnO的化学方程式为________。
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是________。
(3)滤液I可循环使用,应当将其导入到________操作中(填操作单元的名称)。
(4)净化时需先加入的试剂X为________(填化学式)。再使用氨水调溶液的pH,则pH的理论最小值为_______(当溶液中某离子浓度![]() 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为______________________。
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:

(1)元素d基态原子包含____种运动状态不同的电子,这些电子位于____种能量不同的原子轨道中。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____。
(3)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是_____。
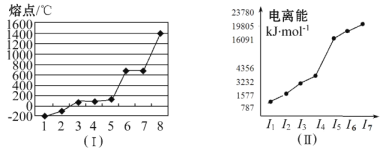
(4)第3周期8种元素按单质熔点高低的顺序如图(Ⅰ)所示,其中电负性最大的是____(填I图中的序号)。表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是_____(填元素名称)。
(5)a、d、l三种元素可形成一种离子化合物,其中的化学键类型除了离子键,还包括____。