题目内容
8.工业上合成氨(N2(g)+3H2(g)?2NH3(g)+Q)适宜条件的选择是化学反应速率原理与化学平衡移动原理的综合利用.(1)从反应速率快慢分析:压强应高(填“高”或低),温度应高(填“高”或“低”),催化剂使用(填“使用”或“不用”).
(2)从平衡移动原理分析;压强应高(填“高”或“低”),温度应低(填“高”或“低”),催化剂不用(填“使用”或“不用”).
(3)实际工业生产中选择压强为C、温度为F、催化剂为H.(填序号)
A.1MPa B.20MPa~50MPa C.100Mpa D.25℃E.100℃
F.500℃G.不用催化剂 H.铁作催化剂 I.五氧化二钒作催化剂.
分析 (1)压强高,温度高,并且使用催化剂反应速率加快;
(2)该反应为气体体积减小的放热反应,使用从平衡移动原理分析;压强高,温度低平衡正向移动,催化剂对平衡移动无影响;
(3)实际工业生产中选择压强为100Mpa、温度为500℃、催化剂为铁作催化剂.
解答 解:(1)因为压强高,温度高,并且使用催化剂反应速率加快,故答案为:高;高;使用;
(2)该反应为气体体积减小的放热反应,使用从平衡移动原理分析;压强高,温度低平衡正向移动,催化剂对平衡移动无影响,故答案为:高;低;不用;
(3)实际工业生产中应考虑催化剂的活性以及生成设备的要求,选择压强为100Mpa、温度为500℃、催化剂为铁作催化剂,故答案为:C;F;H.
点评 本题考查较为综合,涉及化学反应速率的影响、化学平衡的移动等知识,为高考常见题型,侧重于学生的分析能力的考查,注意把握相关知识的积累,难度不大.

练习册系列答案
相关题目
18.溶液、胶体和浊液这三种分散系的根本区别是( )
| A. | 能否透过滤纸 | B. | 能否发生丁达尔效应 | ||
| C. | 分散质粒子的大小 | D. | 是否均一、透明、稳定 |
19.将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)?2G(g).忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如表所示.下列推断不正确的是( )
| 压强/Mpa 体积分数/% 温服/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 该反应的△S>0 | B. | 915℃,2.0 MPa时E的转化率为40% | ||
| C. | b<f | D. | K(1000℃)>K(810℃) |
16.下列各组物质中,互为同素异形体的是( )
| A. | 16O和18O | B. | 白磷和红磷 | C. | 氨气和液氨 | D. | H2和D2 |
3. 某温度时,在2L的密闭容器中,X、Y、Z三种物质(其中X为固体,Y、Z为气体)的物质的量随时间的变化曲线如图所示:
某温度时,在2L的密闭容器中,X、Y、Z三种物质(其中X为固体,Y、Z为气体)的物质的量随时间的变化曲线如图所示:
(1)由图中所给数据进行分析,该反应的化学方程式为X+3Y?2Z;
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=0.05mol•(L•min)-1;
(3)若其它条件不变,只改变一个反应条件,将反应速率的变化填入表中空格里.
(填字母:A.增大 B.减小 C.不变)
 某温度时,在2L的密闭容器中,X、Y、Z三种物质(其中X为固体,Y、Z为气体)的物质的量随时间的变化曲线如图所示:
某温度时,在2L的密闭容器中,X、Y、Z三种物质(其中X为固体,Y、Z为气体)的物质的量随时间的变化曲线如图所示:(1)由图中所给数据进行分析,该反应的化学方程式为X+3Y?2Z;
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=0.05mol•(L•min)-1;
(3)若其它条件不变,只改变一个反应条件,将反应速率的变化填入表中空格里.
(填字母:A.增大 B.减小 C.不变)
| 改变条件 | 降低温度 | 增加X的量 | 使用催化剂 | 容器体积减半 |
| 速率变化 |
13.可以使有色布条褪色的物质是( )
| A. | 液氯 | B. | 氯水 | ||
| C. | 石灰乳与氯水的混合物 | D. | 漂白粉 |
14.下列反应中生成物总能量低于反应物总能量的是( )
| A. | 氢气还原氧化铜 | B. | 高锰酸钾分解 | ||
| C. | 锌放入稀硫酸 | D. | 碳和水蒸气在高温下反应 |
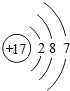 ,它和金属或氢化合时显负价,生成物溶于水后氯元素以无色-1价的阴离子存在,其电子层结构为
,它和金属或氢化合时显负价,生成物溶于水后氯元素以无色-1价的阴离子存在,其电子层结构为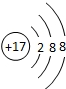 .
.