题目内容
6.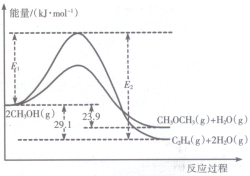 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应i(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
| 起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=4.
分析 Ⅰ、(1)如图分析可知,反应的活化能越小反应速率越快,加入催化剂能降低反应的活化能,催化剂不改变反应物总能量与生成物总能量之差即反应热不变.
(2)分析图象2CH3OH(g)?C2H4(g)+2H2O(g)△H=-29.1KJ/mol,2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.9KJ/mol,CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的热化学方程式可以依据盖斯定律计算得到;
Ⅱ、(3)图表数据都是在恒温容器中进行的反应,达到平衡的方向不同,但反应的平衡常数不变,反应i为2CH3OH(g)?CH3OCH3(g)+H2O(g),反应前后气体体积不变,容器1正向进行,容器2逆向进行,相当于容器1中达到平衡基础上增大压强,平衡不动,但物质浓度增大,反应速率增大,容器3是绝热容器,反应达到平衡容器中温度高于容器1,平衡应逆向进行,平衡常数减小;
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,结合化学平衡三段式列式计算平衡你的,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
解答 解:(1)反应的活化能越小反应速率越快,在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应中反应i和ii相比,反应i的活化能小,反应速率快,加入催化剂改变了反应的途径,降低反应所需的活化能,所以E1和E2的变化是减小,催化剂不改变反应物总能量与生成物总能量之差即反应热不变,E2-E1的大小为反应的焓变,活化能大小对该反应的反应热无影响,
故答案为:ⅰ,该反应的活化能较小;减小;不变;
(2)分析图象得到反应①2CH3OH(g)?C2H4(g)+2H2O(g)△H=-29.1KJ/mol,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.9KJ/mol,
③CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.
依据盖斯定律②-①-③得到乙烯气相直接水合反应的热化学方程式为:
C2H4(g)+H2O(g)=C2H5OH(g)△H=-45.5 kJ•mol-1
故答案为:-45.5 kJ•mol-1;
Ⅱ、(3)图象分析可知,反应为:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.9KJ/mol,图表数据都是在恒温容器中进行的反应,达到平衡的方向不同,但反应的平衡常数不变,K1=K2,反应i为2CH3OH(g)?CH3OCH3(g)+H2O(g),反应前后气体体积不变,容器1正向进行,容器2逆向进行,相当于容器1中达到平衡基础上增大压强,平衡不动,但物质浓度增大,c1(H2O)<c2(H2O),容器3是绝热容器,反应达到平衡容器中温度高于容器1,平衡应逆向进行,平衡常数减小,K1=K2>K3,
故答案为:<,K1=K2>K3;
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始量(mol/L) 2 0 0
变化量(mol/L) 2×80% 0.8 0.8
平衡量(mol/L) 0.4 0.8 0.8
K=$\frac{0.8×0.8}{0.{4}^{2}}$=4,
故答案为:4.
点评 本题考查了化学平衡、平衡常数的影响因素分析判断,平衡常数计算应用,注意图象分析和热化学方程式的分析判断,掌握基础是关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 类比对象 | 结论 | |
| A | Cl2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$HCl+HClO | I2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$HI+HIO |
| B | C+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑ | C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ |
| C | Na2O+H2O=2NaOH | CuO+H2O=Cu(OH)2 |
| D | Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO |
| A. | A | B. | B | C. | C | D. | D |
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:4 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 此有机物的最简式为CH4O |

| A. | 图1所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. | 图2所示装置用于除去碳酸氢钠固体中的少量碳酸钠 | |
| C. | 图3所示装置配制100mL0.1mol•L-1的硫酸 | |
| D. | 图4所示装置用于分离出溴苯 |
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种 | |
| B. | C8H10中只有三种属于芳香烃的同分异构体 | |
| C. | C5H10中只有三种属于直链烯烃的同分异构体(包括空间异构) | |
| D. | 含两个-COOCH3的有机物(C7H12O4)属于酯的同分异构体多于4种 |
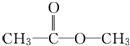 、
、 或
或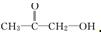 .
.
 .
. ,化合物Ⅳ通过消去反应生成化合物Ⅰ的化学方程式为
,化合物Ⅳ通过消去反应生成化合物Ⅰ的化学方程式为 .
.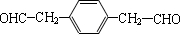 (写一种即可).
(写一种即可). 单体的结构简式为
单体的结构简式为 ;利用题中所给信息,自选合适的原料通过一步反应合成该单体,写出其化学方程式
;利用题中所给信息,自选合适的原料通过一步反应合成该单体,写出其化学方程式 .
.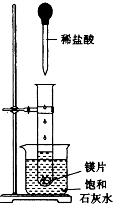 如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:
如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答: