题目内容
【题目】某化学兴趣小组在实验室探究过渡金属元素化合物的性质
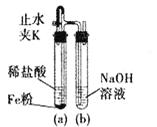
(1)向![]() 溶液中滴加NaOH溶液,产生白色沉淀,但迅速变为灰绿色,最终变为红褐色,为顺利看到较长时间的白色沉淀,设计了如图装置:①检查装置气密性,装入药品;②打开止水夹K;③在试管b出口收集气体并验纯;④关闭止水夹K。以上操作正确的顺序是:________。
溶液中滴加NaOH溶液,产生白色沉淀,但迅速变为灰绿色,最终变为红褐色,为顺利看到较长时间的白色沉淀,设计了如图装置:①检查装置气密性,装入药品;②打开止水夹K;③在试管b出口收集气体并验纯;④关闭止水夹K。以上操作正确的顺序是:________。
(2)某实验小组称量![]() 草酸亚铁晶体
草酸亚铁晶体![]() 加热过程中,固体质量变化如图所示:
加热过程中,固体质量变化如图所示:
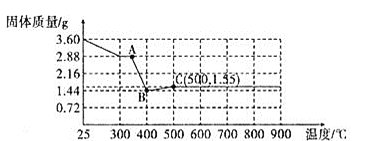
①请写出AB段发生反应的化学方程式:________________。
②![]() 点成分为:________。
点成分为:________。
(3)向![]() 溶液中加入过量
溶液中加入过量![]() 溶液,设计实验证明两者发生了氧化还原反应并且为可逆反应。
溶液,设计实验证明两者发生了氧化还原反应并且为可逆反应。![]() 简要说明实验步骤、现象和结论,仪器和药品自选
简要说明实验步骤、现象和结论,仪器和药品自选![]() ________________。
________________。
【答案】①②③④ ![]()
![]() 取反应后的溶液分成两份,一份滴加KSCN溶液,变红;另一份滴加
取反应后的溶液分成两份,一份滴加KSCN溶液,变红;另一份滴加![]() 溶液,产生特征蓝色沉淀即可说明
溶液,产生特征蓝色沉淀即可说明![]() 其它合理答案均可
其它合理答案均可![]()
【解析】
(1)为顺利看到较长时间的白色沉淀,应该让铁与稀盐酸反应产生的氢气将装置内的空气排尽,然后再利用氢气将生成的氯化亚铁压入氢氧化钠溶液,据此分析;
(2)由图像可知A点质量减少及反应的化学方程式![]() 进行计算;
进行计算;
(3)利用![]() 的生成说明发生氧化还原反应,利用
的生成说明发生氧化还原反应,利用![]() 不足却有剩余说明为可逆反应设计方案。
不足却有剩余说明为可逆反应设计方案。
(1)为顺利看到较长时间的白色沉淀,应该让铁与稀盐酸反应产生的氢气将装置内的空气排尽,然后再利用氢气将生成的氯化亚铁压入氢氧化钠溶液,则步骤为①检查装置气密性,装入药品;②打开止水夹K;③在试管b出口收集气体并验纯;④关闭止水夹K;故答案为:①②③④;
(2)由图像可知A点质量减少![]() ,说明结晶水已完全失去,继续加热草酸亚铁开始分解产生铁的氧化物,根据铁元素质量守恒可计算B点固体成分为FeO,则AB段发生反应的化学方程式为:
,说明结晶水已完全失去,继续加热草酸亚铁开始分解产生铁的氧化物,根据铁元素质量守恒可计算B点固体成分为FeO,则AB段发生反应的化学方程式为:![]() ,FeO不稳定,在空气中加热变为
,FeO不稳定,在空气中加热变为![]() ,则C点成分为
,则C点成分为![]() ;故答案为:
;故答案为:![]() ;
;![]() ;
;
(3)利用![]() 的生成说明发生氧化还原反应,利用
的生成说明发生氧化还原反应,利用![]() 不足却有剩余说明为可逆反应,设计方案为:取反应后的溶液分成两份,一份滴加KSCN溶液,变红;另一份滴加
不足却有剩余说明为可逆反应,设计方案为:取反应后的溶液分成两份,一份滴加KSCN溶液,变红;另一份滴加![]() 溶液,产生特征蓝色沉淀即可说明两者发生了氧化还原反应并且为可逆反应;故答案为:取反应后的溶液分成两份,一份滴加KSCN溶液,变红;另一份滴加
溶液,产生特征蓝色沉淀即可说明两者发生了氧化还原反应并且为可逆反应;故答案为:取反应后的溶液分成两份,一份滴加KSCN溶液,变红;另一份滴加![]() 溶液,产生特征蓝色沉淀即可说明
溶液,产生特征蓝色沉淀即可说明![]() 其它合理答案均可
其它合理答案均可![]() 。
。

【题目】下列实验操作对应的现象不符合事实的是
选项 | 实验操作 | 现象 |
A | 向盛有 | 溶液逐渐变为黄色,滴加KSCN后溶液变血红色 |
B | 向盛有 | 溶液逐渐褪色,静置后观察到溶液有分层现象 |
C | 向 | 先产生白色沉淀,后沉淀消失 |
D | 向盛有 | 有刺激性气味气体产生,溶液变浑浊 |
A.AB.BC.CD.D
【题目】![]() 是工业上常用的硫化剂,已知
是工业上常用的硫化剂,已知![]() 中硫元素显
中硫元素显![]() 价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂。实验室常用
价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂。实验室常用![]() 与纯净的氯气制备
与纯净的氯气制备![]() 。反应涉及到的几种物质的熔沸点如下:
。反应涉及到的几种物质的熔沸点如下:
物质 |
|
|
|
|
沸点 | 47 |
| 77 | 137 |
熔点 |
|
|
|
|
实验室利用下列装置制备![]() (部分夹持仪器己略去):
(部分夹持仪器己略去):
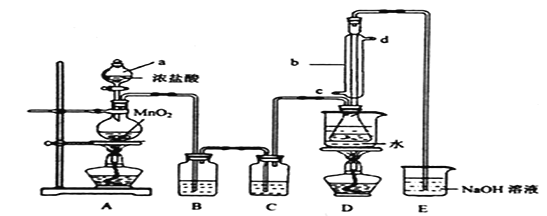
回答下列问题:
(1)装置中b玻璃仪器的名称为_________;写出制备![]() 的化学方程式_________。
的化学方程式_________。
(2)D中采用热水浴加热的原因是 _________,反应结束后从锥形瓶内混合物中分离出产品的方法是______。
(3)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因化学方程式表示为______________。
(4)该实始装置设计存在缺陷,你的改进建议是 _________________________________。
【题目】Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______。
(2)该反应为______反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_____。
a.容器中压强不变 b.υ正(H2)=υ逆(H2O)
c. c(CO2)=c(CO) d.混合气体中 c(CO)不变
(4) 830K时,各物质浓度符合下式:2c(CO2)·c(H2)=c(CO)·c(H2O),此时该反应 _______(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”)。
Ⅱ.将1 mol I2(g) 和2 mol H2置于2 L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)若5分钟该达平衡,则用H2表示的反应速率为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,则甲条件可能是____。(填入下列条件的序号)
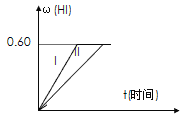
①恒温条件下,缩小反应容器体积;②恒温条件下,扩大反应容器体积;③恒容条件下,降低温度;④恒容条件下,升高温度;⑤恒温恒容条件下,加入适当催化剂。