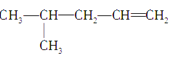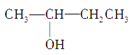题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A.过量的铁在1molCl2中然烧,最终转移电子数为2NA
B.在50g质量分数为46%的乙醇水溶液中,含氢原子总数为6NA
C.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
D.1L1mol/LNaCl溶液和1L1mol/LNaF溶液中离子总数:前者小于后者
【答案】D
【解析】
A.铁过量,1molCl2完全反应转移2mol电子,选项A正确;
B.乙醇有0.5mol,另外还有1.5mol水,故氢原子总数为(0.5mol×6+1.5mol×2)×NA =6NA,选项B正确;
C.反应中每生成4 mol氮气转移15 mol电子,生成28gN2时(物质的量为1mol),转移的电子数目为3.75NA,选项C正确;
D.NaCl溶液不水解,为中性,NaF溶液水解,为碱性,根据电荷守恒,两溶液中离子总数均可表示为2[n(Na+)+n(H+)],Na+数目相等,H+数目前者大于后者,所以L1mol/LNaCl溶液和1L1mol/LNaF溶液中离子总数:前者大于后者,选项D错误;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.在测定空气里氧气含量的实验中,小明采用了如图所用的装置:
装置一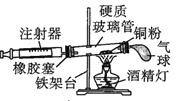 装置二
装置二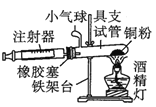
在由注射器和硬质玻璃管组成的密闭系统中留有40mL空气,给装有铜粉的玻璃管加热,观察密闭系统内空气体积变化。
(1)在实验加热过程中,缓慢推动注射器活塞的目的是__________。
(2)装置一比装置二更______(填“合理”或“不合理”),理由是_________。
(3)小明测得的实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
15mL | 10mL |
由此数据可推算出他测定的氧气的体积分数________21%(填“>”“<”或“=”),造成该实验出现误差的原因可能是____________(填序号)。
①推动注射器活塞速度太快 ②未冷却至室温就读数 ③加入铜粉量太少
Ⅱ.H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。
图甲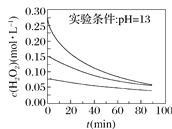 图乙
图乙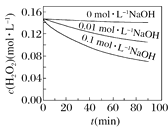
(4)根据上图,将不同条件对速率的影响情况补充完整:图甲表明,____________,H2O2分解速率越快;图乙表明,_________,H2O2分解速率越快。