题目内容
17.0.1mol某烃与20L(标准状况)过量的O2在一定条件下完全反应,将反应后高温下的气体混合物通过过量的Na2O2粉末,使之完全反应.反应后秤得固体粉末增重15g,并最终得到14.4L(标准状况)气体.(1)求该烃的分子式.
(2)该烃可使Br2CCl4溶液褪色,而且没有支链.写出该烃可能的结构简式.
分析 (1)氧气过量,由4H~O2~2H2O、C~O2~CO2、2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2可知,反应前后气体减少的体积是CO2体积的一半;Na2O2粉末与1molH2O及1molCO2反应,质量会分别增加2g、28g,根据n=$\frac{V}{{V}_{m}}$计算出生成二氧化碳的物质的量,结合总质量列式计算出水的物质的量,从而可计算出该有机物的分子式;
(2)该烃分子式为C5H10,可以使Br2的CCl4溶液褪色,其分子中含有碳碳双键,再结合呈直链状写出其结构简式.
解答 解:(1)氧气过量,由4H~O2~2H2O、C~O2~CO2、2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2可知,O2减少的体积是CO2体积的一半;Na2O2粉末与1molH2O及1molCO2反应,质量会分别增加2g、28g,
n(CO2)=$\frac{2(20-14.4)L}{22.4L/mol}$=0.5mol,
28n(CO2)+2n(H2O)=15g,
n(H2O)=0.5mol,
则0.1mol该烃含C原子0.5 mol,含H原子1 mol,则其分子式为:C5H10,
答:该烃的分子式为:C5H10;
(2)该烃分子式为C5H10,可以使Br2的CCl4溶液褪色,该分子中肯定含有碳碳双键,呈直链状,则结构简式为:CH2=CHCH2CH2CH3和CH3CH=CHCH2CH3,
答:该烃可能的结构简式为:CH2=CHCH2CH2CH3和CH3CH=CHCH2CH3.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,根据反应方程式得出二氧化碳的物质的量为解答关键,注意差量法在化学计算中的应用方法.

| A. | 酸性AgNO3溶液 | B. | HCl溶液 | C. | 稀NaOH溶液 | D. | 酸性CuSO4溶液 |
| A. | N2: | B. | NH3 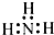 | C. | H2O H+[:O:]2-H+ | D. | NaCl  |
| A. | X元素的氢化物的水溶液显碱性 | |
| B. | Z元素的离子半径大于W元素的离子半径 | |
| C. | Z元素的单质在一定条件下能与X元素的单质反应 | |
| D. | Y元素的氧化物是含有极性键的非极性分子 |
| A. | 镁与二氧化碳反应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 木炭在氧气中燃烧 |
| A. | HI、HBr、HCl、HF | B. | HCl、H2S、PH3、SiH4 | ||
| C. | H2O、H2S、HCl、HBr | D. | HF、H2O、PH3、NH3 |
| A. | 在元素周期表里,主族元素所在的族序数等于原子核外电子数 | |
| B. | 在元素周期表里,元素所在的周期序数等于原子核外电子层数 | |
| C. | 最外层电子数为8的粒子是稀有气体元素的原子 | |
| D. | 元素的原子序数越大,其原子半径也越大 |
| A. | a+b<c+d,Q>0 | B. | a+b>c+d,Q>0 | C. | a+b<c+d,Q<0 | D. | a+b=c+d,Q>0 |