题目内容
2.下列反应中反应物的总能量比生成物低的是( )| A. | 镁与二氧化碳反应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 木炭在氧气中燃烧 |
分析 反应物总能量高于反应物总能量,应为放热反应,常见放热反应有大多数化合反应、酸碱中和反应、金属与酸的反应,物质的燃烧等,
生成物总能量高于反应物总能量,应为吸热反应,常见吸热反应有大多数分解反应,C、CO等还原剂与金属氧化物的反应,Ba(OH)2•8H2O与NH4Cl反应等,
反应中反应物的总能量比生成物低,反应是吸热反应,以此分析选项.
解答 解:反应中反应物的总能量比生成物低,说明反应是吸热反应;
A、镁与二氧化碳是燃烧反应属于放热反应,故A错误;
B、铁和稀硫酸的反应是发生的氧化还原反应,反应放热,故B错误;
C、氢氧化钡晶体的粉末和氯化铵晶体混合是吸热反应,故C正确;
D、木炭在氧气中燃烧是放热反应,故D错误;
故选C.
点评 本题考查反应热与焓变,侧重于基础知识的考查,为高频考点,注意把握常见吸热反应与放热反应,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列反应中,属于加成反应的是(反应条件都已略去)( )
| A. | CH4+Cl2→CH3Cl+HCl | B. | CH2=CH2+H2O→CH3CH2OH | ||
| C. |  +HO-NO2→ +HO-NO2→ +H2O +H2O | D. | CH3CH2OH→CH2=CH2+H2O |
13.如图是部分短周期元素原子半径与原子序数的关系图.字母代表元素,分析正确的是( )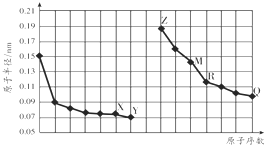

| A. | R在周期表的第15列 | |
| B. | 元素Y气态氢化物的沸点小于元素Q气态氢化物的沸点 | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
10.两种短周期元素组成的化合物中,原子个数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系中可能是( )
①a=b+5 ②a+b=30 ③a+b=8 ④a-b=8.
①a=b+5 ②a+b=30 ③a+b=8 ④a-b=8.
| A. | ②③ | B. | ②③④ | C. | ①②③④ | D. | ③④ |
14.关于化学电源的说法不正确的是( )
| A. | 充电电池可重复使用是因为所发生的反应可逆向进行 | |
| B. | 充电电池工作时所发生的反应属可逆反应 | |
| C. | 燃料电池的反应物由外设装备提供 | |
| D. | 氢氧燃料电池工作时负极生成的H+向正极移动 |
11.第3周期元素的原子,其最外层的3p层上有一个未成对电子,它的最高价氧化物对应水化物的酸根离子是( )
| A. | RO4- | B. | RO3- | C. | RO42- | D. | RO5- |
15.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA | |
| B. | 标况下,22.4L SO3含有NA个H2O分子 | |
| C. | 78g Na2O2与足量水充分反应时电子转移数为2NA | |
| D. | 4℃、101.3kPa时,54mL H2O中含有的分子数为3NA |