题目内容
9.下列气态氢化物的稳定性按逐渐减弱顺序排列的是( )| A. | HI、HBr、HCl、HF | B. | HCl、H2S、PH3、SiH4 | ||
| C. | H2O、H2S、HCl、HBr | D. | HF、H2O、PH3、NH3 |
分析 元素非金属性越强,气态氢化物越稳定,由此分析.
解答 解:A、同主族中,由上到下,随核电荷数的增加,非金属性减弱,卤化氢稳定性为HF>HCl>HBr>HI,故A错误;
B、同周期元素的原子从左到右,得电子能力逐渐增强,氢化物的稳定性逐渐增强,稳定性:HCl>H2S>PH3>SiH4,故B正确;
C、非金属性O>Cl>Br>S,所以氢化物的稳定性:H2O>HCl>HBr>H2S,故C错误;
D、非金属性F>O>N>P,所以氢化物的稳定性:HF>H2O>NH3>PH3,故D错误;
故选B.
点评 本题考查学生元素周期律的知识,可以根据所学知识来回答,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列说法正确的是( )
| A. | 根据反应Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑可推出Cu的还原性比H2的强 | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色,证明氧化性:H2O2比Fe3+强 | |
| D. | 在2Na+2C+2NH3=2NaCN+3H2↑反应中的还原剂为C和Na |
20.下列说法正确的是( )
| A. | 含有极性键的分子一定是极性分子 | |
| B. | 键能越大,表示该分子越容易受热分解 | |
| C. | 在分子中,两个成键的原子间的距离叫做键长 | |
| D. | H-Cl的键能为431.8KJ/mol,H-I的键能为298.7 KJ/mol,这可以说明HCl比HI分子稳定 |
14.关于化学电源的说法不正确的是( )
| A. | 充电电池可重复使用是因为所发生的反应可逆向进行 | |
| B. | 充电电池工作时所发生的反应属可逆反应 | |
| C. | 燃料电池的反应物由外设装备提供 | |
| D. | 氢氧燃料电池工作时负极生成的H+向正极移动 |
1.下列叙述正确的是( )
| A. | 分子式为C3H6有机物最多存在4个C-C单键,与C4H10的碳碳单键数相同 | |
| B. | 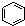 和 和 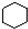 均是芳香烃, 均是芳香烃,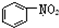 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| C. | 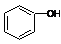 和 和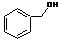 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此推测可能有H-O键 |
1.蛇纹石可用于生产氢氧化镁,简要工程如下:
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁,将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol•L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁,向步骤II所得溶液中加入过量氨水.已知:金属离子氢氧化物沉淀所需pH
请回答:
(1)步骤Ⅱ中加入适量的0.1mol•L-1H2O2的目的是将Fe2+氧化成Fe3+;可用于调节溶液pH至7~8的最佳试剂是A(填字母序号)
A.MgO B.Na2CO3 C.蒸馏水 D.NaOH
(2)工业上常以Mg2+的转化率为考查指标,确定步骤Ⅲ制备氢氧化镁工艺过程的适宜条件.其中,反应温度与Mg2+转化率的关系如图所示.
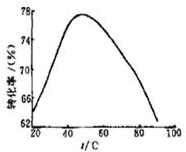
①步骤Ⅲ中制备氢氧化镁反应的离子方程式为Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+.根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是吸热(填“吸热”或“放热”反应)
②图中,温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁,将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol•L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁,向步骤II所得溶液中加入过量氨水.已知:金属离子氢氧化物沉淀所需pH
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)步骤Ⅱ中加入适量的0.1mol•L-1H2O2的目的是将Fe2+氧化成Fe3+;可用于调节溶液pH至7~8的最佳试剂是A(填字母序号)
A.MgO B.Na2CO3 C.蒸馏水 D.NaOH
(2)工业上常以Mg2+的转化率为考查指标,确定步骤Ⅲ制备氢氧化镁工艺过程的适宜条件.其中,反应温度与Mg2+转化率的关系如图所示.

①步骤Ⅲ中制备氢氧化镁反应的离子方程式为Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+.根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是吸热(填“吸热”或“放热”反应)
②图中,温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
2.用铝还原下列化合物,制得金属各1mol,消耗铝最少的是( )
| A. | MnO2 | B. | WO3 | C. | Co3O4 | D. | Cr2O3 |