题目内容
6.能说明氯元素的非金属性比硫元素强的事实是( )| A. | HCl比H2S稳定 | B. | 常温下Cl2为气体,S单质为固体 | ||
| C. | 单质S可以在空气中燃烧Cl2不能 | D. | 溶于水时HCl是强酸而H2S是弱酸 |
分析 利用非金属与氢气化合的难易程度、气态氢化物的稳定性、最高价氧化物的水化物的酸性、非金属单质之间的置换反应等来判断非金属性的强弱,以此来解答.
解答 解:A.元素的非金属性越强,对应氢化物的稳定性越强,HCl比H2S稳定,则Cl的非金属性比S的强,故A正确;
B.物质的状态属于物理性质,不能根据物质的状态判断非金属性,所以不能说明氯元素的非金属性比硫元素强,故B错误;
C.单质S可以在空气中燃烧Cl2不能,不能说明氯元素的非金属性比硫元素强,故C错误
D.不能根据氢化物的酸性,要根据氢化物的稳定性来判断非金属性,故D错误;
故选A.
点评 本题考查非金属性的比较,题目难度不大,注意归纳非金属性比较的常见方法即可解答,注重规律性知识的应用来解答.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
16.现有下列几组粒子:①N2、CO;②NH4+、OH-;③O22-、CN-;④PO43-、ClO4-.对上述四组粒子归类正确的是( )
| A. | 质子数相等、电子数和原子数不相等:① | |
| B. | 质子数和电子数相等、原子数不相等:② | |
| C. | 电子数相等、质子数和原子数不相等:③ | |
| D. | 原子数和电子数相等、质子数不相等:④ |
14.可逆反应 2A(s)+3B(g)?C(g)+2D(g)△H<0,在一定条件下达到平衡,下列有关叙述正确的是( )
| A. | 增加A的量,B的转化率提高 | |
| B. | 压强增大平衡不移动,v(正)、v(逆)均不变 | |
| C. | 增大B的浓度,v(正)>v(逆) | |
| D. | 升高温度,平衡向逆反应方向移动,v(正)减小 |
1.在实验室里可按如图所示装置干燥并收集气体R,且吸收多余的R,则R是( )

| A. | CH4 | B. | NH3 | C. | HCl | D. | O2 |
18.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)已知BA5为离子化合物,写出其电子式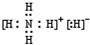 .
.
(2)B基态原子中能量最高的电子,其电子云在空间有3个伸展方向,原子轨道呈纺锤形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,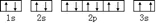 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.
(4)G位于ⅦB族d区,价电子排布式为3d54s2.
(5)DE3中心原子的杂化方式为sp3.
(6)C和F的第一电离能大小关系为Mg>K(用元素符号表示)
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
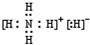 .
.(2)B基态原子中能量最高的电子,其电子云在空间有3个伸展方向,原子轨道呈纺锤形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.(4)G位于ⅦB族d区,价电子排布式为3d54s2.
(5)DE3中心原子的杂化方式为sp3.
(6)C和F的第一电离能大小关系为Mg>K(用元素符号表示)
15.据科学家预测,月球的土壤中吸附着数百万吨的${\;}_{2}^{3}$He,每百吨${\;}_{2}^{3}$He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上氦元素主要以${\;}_{2}^{4}$He的形式存在.下列说法正确的是( )
| A. | ${\;}_{2}^{4}$He原子核内含有4个质子 | B. | ${\;}_{2}^{3}$He原子核内含有3个中子 | ||
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同素异形体 |
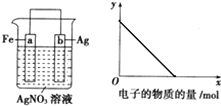 按如图装置进行实验,若x轴表示流入正极的电子的物质的量,则y轴可以表示( )
按如图装置进行实验,若x轴表示流入正极的电子的物质的量,则y轴可以表示( )
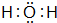 ,B的化学式NH3,C的离子符号NH4+
,B的化学式NH3,C的离子符号NH4+