题目内容
【题目】锌是一种常用金属,冶炼方法有火法和湿法。回答下列问题:
I. 镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga在元素周期表中的位置为_______________。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为_______________。
(3)下列有关镓和镓的化合物的说法正确的是_____________(填字母)。
A. 一定条件下,Ga可溶于盐酸和氢氧化钠溶液
B. 常温下,Ga可与水剧烈反应放出氢气
C. Ga2O3可由Ga(OH)3受热分解得到
D. 一定条件下,Ga2O3可与NaOH反应生成盐
II. 工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示。
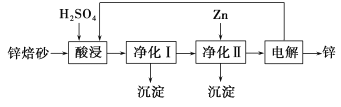
已知:Fe的活泼性强于Ni。
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式___________________。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,仅使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________________________。
(6)净化II中加入Zn的目的是_______________________________________。
III. (7)某化学课外小组拟用废旧电池锌皮(含杂质铁),结合如图所示信息,从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。

实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1的稀硫酸,加入_______(选填字母,下同);
A. 30%H2O2 B. 新制氯水
C. FeCl3溶液 D. KSCN溶液
②加入__________;
A. 纯锌粉 B. 纯碳酸钙粉末
C. 纯ZnO粉末 D. 3mol·L-1的稀硫酸
③加热到60℃左右并不断搅拌;
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是________________________________。
【答案】第四周期IIIA族 2Ga+2NH3![]() 2GaN+3H2 ACD ZnFe2O4+4H2SO4 ==== ZnSO4+Fe2(SO4)3+4H2O Fe(OH)3胶粒具有吸附性 使Cu2+、Ni2+转化为Cu、Ni而除去 A C 促进Fe3+水解转化为沉淀,并使过量的H2O2分解除去
2GaN+3H2 ACD ZnFe2O4+4H2SO4 ==== ZnSO4+Fe2(SO4)3+4H2O Fe(OH)3胶粒具有吸附性 使Cu2+、Ni2+转化为Cu、Ni而除去 A C 促进Fe3+水解转化为沉淀,并使过量的H2O2分解除去
【解析】
Ⅰ(1)Ga的原子序数为31,位于第四周期第ⅢA族;
(2)Ga和NH3在高温条件下反应生成GaN和氢气,反应为2Ga+2NH3![]() 2GaN+3H2
2GaN+3H2
(3)镓与铝同主族且相邻,化学性质与铝相似,则
A、Al与盐酸、NaOH均反应,则一定条件下,Ga可溶于盐酸和氢氧化钠,故A正确;
B、Al与水常温不反应,则常温下,Ga不能与水剧烈反应放出氢气,故B错误;
C、氧化铝可由氢氧化铝分解生成,则Ga2O3可由Ga(OH)3受热分解得到,故C正确;
D、氧化铝与NaOH反应生成盐,则一定条件下,Ga2O3可与NaOH反应生成盐,故D正确;
故答案为:ACD;
Ⅱ(4)根据信息,酸浸时ZnFe2O4会生成两种盐,这两种盐分别为硫酸锌、硫酸铁,即ZnFe2O4与硫酸反应生成硫酸锌、硫酸铁,反应的化学方程式为:ZnFe2O4+4H2SO4=ZnSO4+Fe2(SO4)3+4H2O;
(5)因为生成的Fe(OH)3胶粒具有吸附性,能净化I生成的沉淀中还含有溶液中的悬浮杂质;
(6)CaO、FeO、CuO、NiO等氧化物溶于酸转化为金属离子,净化I后除去Fe元素,净化II中加入Zn的目的是使Cu2+、Ni2+转化为Cu、Ni而除去;
(7)据题意用废旧干电池锌皮(含杂质铁)制取纯净的ZnSO4溶液实验流程为用硫酸酸溶、除杂。由实验步骤①将锌片完全溶于稍过量的3 mol·L-1稀硫酸发生的反应为Zn + 2H+= Zn2++ H2↑、Fe + 2H+=Fe2++ H2↑,所得溶液中含有杂质离子Fe2+,必须将其除去,结合图像所给信息Zn2+和Fe2+难以分离,必须先将Fe2+氧化为Fe3+再进行分离,为不引进新的杂质,选用30%H2O2作氧化剂;
(8)分离Zn2+和Fe3+的方法结合图像可用盐类水解原理通过调节pH的方法进行除杂,为防止引进杂质可用纯ZnO粉末来调节pH,使Fe3+转化为Fe(OH)3沉淀而除去;
(9)因盐类水解吸热,H2O2受热易分解,所以步骤③加热的主要目的有促进Fe3+水解转化为沉淀并使过量的H2O2分解除去。





