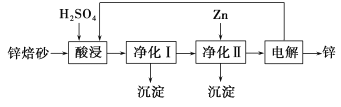
题目内容
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液。
(1)写出0.1 mol·L-1一元弱酸HA的电离方程式___________________。
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为_____________________。
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为___________________;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是_________________。
①c(H+) ②n(A-) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA)
(5)实验室在配制溶液时,一些物质存在水解的情况,在配制Fe2(SO4)3溶液时,Fe3+也存在水解,请书写水解离子方程式____________________________。
【答案】HAH++A- 5.0×10-14 19:11 ②③⑤ Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
【解析】
(1)一元弱酸不完全电离;
(2)依据溶液中离子积Kw=c酸(H+)×c(OH-)计算;
(3)根据酸碱反应酸过量,以氢离子浓度进行求算;
(4)酸溶液越稀c(H+)越小;
②弱酸越稀,其电离度越大,电离程度增大,n(A-)增大;
③温度不变,水的离子积Kw =c(H+)×c(OH-)不变;
④ Ka只与温度有关;
⑤Ka=![]() 不变,c(H+)变小,
不变,c(H+)变小,![]() 增大;
增大;
(5)Fe3+水解产生氢氧化铁,溶液呈酸性。
(1)一元弱酸不完全电离,HA的电离方程式为HAH++A-;
(2)溶液中硫酸电离的氢离子浓度=2×0.1mol/L=0.2mol/L;
依据溶液中离子积Kw=c酸(H+)×c(OH-)=10-14,故c(OH-)=5×10-14mol/L,
得到溶液中由水电离产生的c水(H+)=c(OH-)=5×10-14mol/L;
(3)c(H+)=![]() ,则所需NaOH溶液与硫酸的体积比为19:11;
,则所需NaOH溶液与硫酸的体积比为19:11;
(4)①酸溶液越稀c(H+)越小,故错误;
②弱酸越稀越电离,电离程度增大n(A-)增大,故正确;
③酸溶液越稀c(H+)越小,温度不变,水的离子积Kw =c(H+)×c(OH-)不变,c(OH-)增大,故正确;
④ Ka只与温度有关,Ka不变,故错误;
⑤Ka=![]() 不变,c(H+)变小,
不变,c(H+)变小,![]() 增大,故正确;
增大,故正确;
答案选②③⑤;
(5)Fe3+水解产生氢氧化铁,溶液呈酸性,水解离子方程式为Fe3++3H2O![]() Fe(OH)3+3H+。
Fe(OH)3+3H+。