题目内容
【题目】氯化亚铜是化工和印染等行业的重要原料,广泛用作有机合成的催化剂。
Ⅰ.甲采用CuCl2·2H2O热分解法制备CuCl,装置如图。

(1)仪器X的名称是_______________,C中烧杯的试剂可以是__________。
(2)“气体入口”通入的气体是_______。
(3)反应结束后,取所得产品分析,发现其中含有氧化铜,其可能原因是______________。
Ⅱ.乙另取纯净CuCl2固体用如下方法制备CuCl。

(4)操作②中反应的离子方程式为___________________。
(5)操作①中若用100 mL 10 mol/L盐酸代替0.2 mol/L盐酸,再通入SO2后,无白色沉淀产生。对此现象有如下两种猜想:
猜想一:c(H+)过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、100 mL0.2 mol/L盐酸及________mL10.0mol/LH2SO4配制成200 mL溶液,再进行操作②,观察是否有白色沉淀产生。
猜想二:_______________。请设计实验说明该猜想是否成立:_________________。
【答案】硬质玻璃管 NaOH溶液 HCl HCl气流不足,导致Cu2+水解产生氢氧化铜,受热分解所得 SO2+2Cu2++2Cl-+2H2O=SO42-+2CuCl↓+4H+ 49 c(Cl-)过大导致白色沉淀溶解 取少量白色沉淀加入到饱和氯化钠溶液中,搅拌,若白色沉淀溶解,说明猜想二成立,反之不成立
【解析】
I.热分解CuCl22H2O制备CuCl,发生的反应为2CuCl2·2H2O ![]() 2CuCl+Cl2↑+4H2O,因为氯化铜是强酸弱碱盐,CuCl2·2H2O受热时可能发生水解反应生成氢氧化铜和氯化氢,为抑制水解,气体入口需要通入HCl气体,然后加热A处试管,干燥管中无水硫酸铜变蓝,可以检验生成的水,D中NaOH溶液吸收尾气;
2CuCl+Cl2↑+4H2O,因为氯化铜是强酸弱碱盐,CuCl2·2H2O受热时可能发生水解反应生成氢氧化铜和氯化氢,为抑制水解,气体入口需要通入HCl气体,然后加热A处试管,干燥管中无水硫酸铜变蓝,可以检验生成的水,D中NaOH溶液吸收尾气;
Ⅱ.(4)操作②为向含有铜离子、氯离子的溶液中通入二氧化硫气体,生成CuCl沉淀,据此书写反应的方程式;
(5)根据氢原子守恒分析解答;根据盐酸中含有的离子结合题意猜想并验证。
I.(1)根据图示,仪器X为硬质玻璃管,2CuCl2·2H2O ![]() 2CuCl+Cl2↑+4H2O,氯气有毒,所以氯气在C中用氢氧化钠吸收,故答案为:硬质玻璃管;NaOH溶液;
2CuCl+Cl2↑+4H2O,氯气有毒,所以氯气在C中用氢氧化钠吸收,故答案为:硬质玻璃管;NaOH溶液;
(2)因为氯化铜是强酸弱碱盐,CuCl2·2H2O受热时可能发生水解反应生成氢氧化铜和氯化氢,为了抑制水解,需要在 “气体入口”通入HCl,故答案为:HCl;
(3)HCl气流不足,导致Cu2+水解产生氢氧化铜,氢氧化铜受热分解生成氧化铜,故答案为:HCl气流不足,导致Cu2+水解产生氢氧化铜,受热分解所得;
Ⅱ.(4)操作②为向含有铜离子、氯离子的溶液中通入二氧化硫气体,反应为SO2+2Cu2++2Cl-+2H2O =SO42-+2CuCl↓+4H+,故答案为:SO2+2Cu2++2Cl-+2H2O =SO42-+2CuCl↓+4H+;
(5)设10.0mol/LH2SO4的体积为VmL,则0.2×0.1+V×10.0×2=10×0.1,解之得V=49mL,猜想二:结合盐酸中的离子进行猜想,可能是氯离子的浓度过大,导致白色沉淀溶解,可以取少量白色沉淀加入到饱和氯化钠溶液中,搅拌,若白色沉淀溶解,说明猜想二成立,反之不成立,故答案为:49;c(Cl-)过大导致白色沉淀溶解;取少量白色沉淀加入到饱和氯化钠溶液中,搅拌,若白色沉淀溶解,说明猜想二成立,反之不成立。

【题目】ⅥA族元素形成的化合物在实验室和工业生产上有着广泛的应用。回答下列问题:
(1)SCN-与Fe3+可形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使Fe3+的剩余价电子压缩配对,则每个配离子中Fe3+的单电子个数为_________个。
(2)Se与S是同族元素,请写出基态Se原子电子排布式_____________。H2Se的酸性比H2S________(填“强”或“弱”)。H2O、H2S、H2Se沸点由高到低的顺序为__________________,原因是:___________。
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为_______,其VSEPR构型为_____________。
(4)已知S4O62-的结构为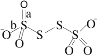 ,其中S原子的杂化方式是_______________。键长a______b(填“>”、“<”或“=”)。
,其中S原子的杂化方式是_______________。键长a______b(填“>”、“<”或“=”)。
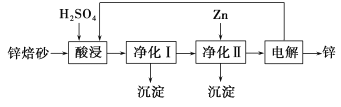
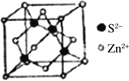
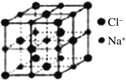
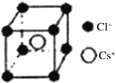
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
典型化学式 | 立方ZnS | NaCl | CsCl |
晶胞 |
|
|
|
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为M g/mol,则阳离子配位数为___________,晶体的密度为_________g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。