题目内容
2.某温度(t℃)时,水的Kw=10-13 mol2•L-2,则该温度(填大于、小于或等于)大于25℃,其理由是温度升高,水的电离程度增大,氢离子和氢氧根离子浓度增大.分析 水的电离是吸热反应,升高温度促进水电离,则溶液的离子积常数增大,通过比较t℃)时和25℃时Kww的值判断.
解答 解:水的电离是吸热反应,升高温度促进水电离,氢离子和氢氧根离子浓度增大,则水的离子积常数增大,25℃时纯水中c(H+)=c(OH-)=10-7 mol/L,Kw=c(H+)•c(OH-)=10-14 ,某温度(T℃)时,水的离子积常数Kw=1×10-13>10-14,则该温度大于25℃,
故答案为:大于;温度升高,水的电离程度增大,氢离子和氢氧根离子浓度增大.
点评 本题考查了水的电离平衡、水的离子积常数的影响因素,注意知识的归纳和梳理是关键,难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
3.根据下列实验事实判断所测液体样品最有可能是纯水的是( )
| A. | 室温下测定其pH等于7 | |
| B. | 一个标准大气压下测定其沸点为100℃ | |
| C. | 电解时产生H2、O2的体积比为2:1 | |
| D. | 室温时为无色的液体 |
7.已知C5H11Br有8种同分异构体,则C6H12O2属于羧酸的结构有( )
| A. | 4种 | B. | 8种 | C. | 7种 | D. | 6种 |
14.下列物质加入水中,显著放热的是( )
| A. | 生石灰 | B. | 固体NaOH | C. | 无水乙醇 | D. | 固体硝酸铵 |
11.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| B. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| C. | 0.1 mol•L-1稀硫酸中硫酸根离子个数为0.1 NA | |
| D. | 22gCO2与11.2LHCl含有相同的分子数 |
12.下列各组有机物只用一种试剂无法鉴别的是( )
| A. | 苯、甲苯、环己烷 | B. | 甲苯、苯酚、己烯 | ||
| C. | 甲酸、乙醛、乙酸 | D. | 乙二醇、苯、四氯化碳 |

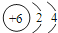 ,AB2中的化学键是共价键
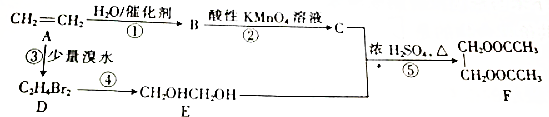
,AB2中的化学键是共价键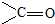 )的化合物反应生成醇:
)的化合物反应生成醇: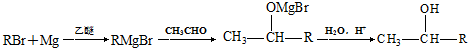
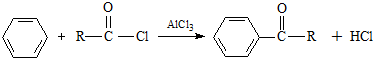
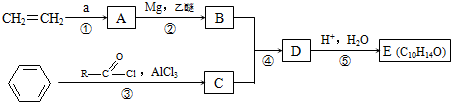
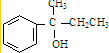 ,F
,F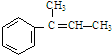 ,G
,G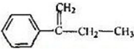 .
.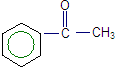 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$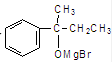 .
.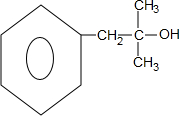 ;若E′与浓硫酸共热不能得到碳链不变的烯烃,则E′可能的结构简式为
;若E′与浓硫酸共热不能得到碳链不变的烯烃,则E′可能的结构简式为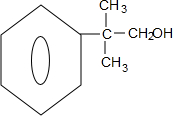 .
.