题目内容
10.下列有关物质的性质和该性质的应用均正确的是( )| A. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| B. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| C. | 常温下浓硫酸使铝钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| D. | 二氧化氮溶于水时只生成唯一产物硝酸,工业上利用这一原理生产硝酸 |
分析 A.SiO2能与氢氟酸反应;
B.利用强氧化性杀菌消毒;
C.根据浓硫酸的特性可知,常温下浓硫酸使铝钝化,生成一层致密的保护膜阻止反应进一步进行;
D.二氧化氮溶于水生成硝酸和一氧化氮.
解答 解:A.SiO2能与氢氟酸反应,玻璃中含有二氧化硅,氢氟酸能够腐蚀玻璃,不能用石英制造容器盛放氢氟酸,故A错误;
B.利用强氧化性杀菌消毒,则二氧化氯具有氧化性,可用于自来水的杀菌消毒,故B错误;
C.因浓硫酸具有强氧化性,能够与大多数金属反应,但遇到金属铝要发生钝化,因此常温下用铝制贮罐贮运浓硫酸,故C正确;
D.二氧化氮溶于水生成硝酸和一氧化氮两种产物,故D错误;
故选:C.
点评 本题考查常见物质的用途,熟悉二氧化硅、浓硫酸、二氧化氮等物质的性质即可解答,注意钝化属于化学反应.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
20.化学反应的实质是旧键的断裂和新键的生成,在探讨发生反应的分子中化学键在何处断裂的问题时,近代科技常用同位素示踪原子法.如有下列反应: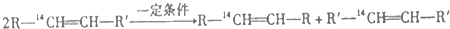
可以推知,化合物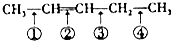 反应时断裂的化学键应是( )
反应时断裂的化学键应是( )
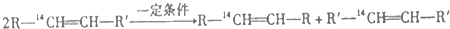
可以推知,化合物
 反应时断裂的化学键应是( )
反应时断裂的化学键应是( )| A. | ①③ | B. | ①④ | C. | ② | D. | ②③ |
1.随着社会的发展,人们日益重视环境问题,下列说法不正确的是( )
| A. | 绿色化学的核心是利用化学原理从源头上减少和消除化学工业生产对环境的污染 | |
| B. | 对废旧电池进行回收处理主要是为了防止重金属污染水源和土壤 | |
| C. | 采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体 | |
| D. | PM2.5是指大气中直径接近于2.5×10-6m的细颗粒物,它们分散在空气中形成的混合物具有丁达尔效应 |
5.下列各组离子一定能大量共存的是( )
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 在使酚酞变红的溶液中:Na+、K+、AlO2-、CO32- | |
| C. | 在水电离产生的c(OH-)=1×10-14mol•L-1的溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 在pH试纸变深红色的溶液中:K+、Fe2+、Cl-、NO3- |
15.下列化学用语正确的是( )
| A. | H2O2的电子式 | |
| B. | 甲醛的结构简式:CH2O | |
| C. | N2的结构式::N≡N: | |
| D. | 质子数为53、中子数为72的碘原子:${\;}_{53}^{125}$I |
2.在25℃时,浓度均为0.2mol/L的NaHCO3和Na2CO3溶液中,下列判断正确的是( )
| A. | c(OH-)前者大于后者 | |
| B. | 与同浓度的盐酸反应时的反应速率前者大于后者 | |
| C. | 分别加入1L的0.2 mol/L的HNO3 后一定产生4.48LCO2 | |
| D. | 溶液中阳离子浓度相同 |
14.下列物质加入水中,显著放热的是( )
| A. | 生石灰 | B. | 固体NaOH | C. | 无水乙醇 | D. | 固体硝酸铵 |

 ,AB2中的化学键是共价键
,AB2中的化学键是共价键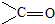 )的化合物反应生成醇:
)的化合物反应生成醇: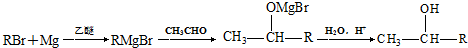


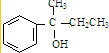 ,F
,F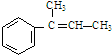 ,G
,G .
. $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$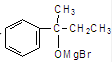 .
. ;若E′与浓硫酸共热不能得到碳链不变的烯烃,则E′可能的结构简式为
;若E′与浓硫酸共热不能得到碳链不变的烯烃,则E′可能的结构简式为 .
.