题目内容
3.人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图.下列说法不正确的是( )
| A. | B是电源的负极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将增大 | |
| C. | 阳极室中发生的电极反应为:2Cl--2e-=Cl2↑ | |
| D. | 阳极室中发生的反应为:CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl |
分析 A、根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律,结合本题图中的电极产物CO2和N2可以判断出A为电源的正极,B为电源的负极;
B、阴极反应为:6H2O+6e-═6OH-+3H2↑(或6H++6e-═3H2↑)阳极反应为:6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;
C、由图可知,阳极室首先是氯离子放电生成氯气;
D、由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl.
解答 解:A、由图可知,左室电极产物为CO2和N2,发生氧化反应,故A为电源的正极,右室电解产物H2,发生还原反应,故B为电源的负极,故A正确;
B、阴极反应为6H2O+6e-═6OH-+3H2↑(或6H++6e-═3H2↑),阳极反应为6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变,故B错误;
C、由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的电极反应为:2Cl--2e-═Cl2↑,故C正确;
D、由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,所以阳极室中发生的反应为CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,故D正确;
故选:B.
点评 本题考查电解池原理与有关计算,难度较大,关键注意观察电极产物,判断发生的反应,注意根据方程式判断左室中pH值的变化.

| A. | 生石灰 | B. | 固体NaOH | C. | 无水乙醇 | D. | 固体硝酸铵 |
| A. | 常温常压下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| B. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| C. | 0.1 mol•L-1稀硫酸中硫酸根离子个数为0.1 NA | |
| D. | 22gCO2与11.2LHCl含有相同的分子数 |
| A. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI $\frac{\underline{\;高温\;}}{\;}$ CeI4+2H2↑ | |
| B. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+═Ce3++2Fe3+ | |
| C. | 金属Ce保存时,应该隔绝空气和水 | |
| D. | 铈的四种核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同素异形体 |
| A. | NaCl | B. | Cl2 | C. | HCl | D. | NaOH |
| A. | 两个相邻同系物的分子量数值一定相差14 | |
| B. | 具有相同通式的有机物不一定互为同系物 | |
| C. | 分子为C3H8与C6H14的两种有机物一定互为同系物 | |
| D. | 分子组成相差一个或几个CH2原子团的化合物必定互为同系物 |
| A. | 苯、甲苯、环己烷 | B. | 甲苯、苯酚、己烯 | ||
| C. | 甲酸、乙醛、乙酸 | D. | 乙二醇、苯、四氯化碳 |
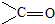 )的化合物反应生成醇:
)的化合物反应生成醇: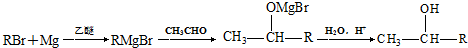


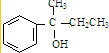 ,F
,F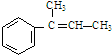 ,G
,G .
. $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$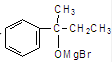 .
. ;若E′与浓硫酸共热不能得到碳链不变的烯烃,则E′可能的结构简式为
;若E′与浓硫酸共热不能得到碳链不变的烯烃,则E′可能的结构简式为 .
.