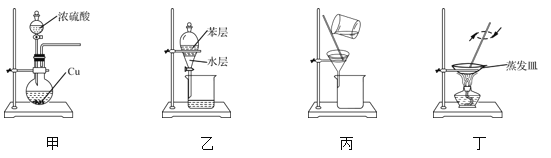
题目内容
【题目】下列实验操作中,错误的是( )
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.不能用酒精萃取碘水溶液中的碘
C.蒸馏时,应使温度计水银球位于蒸馏烧瓶支管处
D.可以用pH试纸测定氯水的酸碱性
【答案】D
【解析】
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,A正确;
B.酒精和水任意比互溶,因此不能用酒精萃取碘水溶液中的碘,B正确;
C.蒸馏时,应使温度计水银球位于蒸馏烧瓶支管处,C正确;
D.氯水中含有次氯酸,会使pH试纸褪色,所以不能用pH试纸测定氯水的酸碱性,D错误;
答案选D。

【题目】如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____(填“正极”或“负极”),通氢气一极的电极反应式为_________________;
(2)铁电极为_______(填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________。
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为______g;
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:

已知:几种金属阳离子开始沉淀和沉淀完全的pH:
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.0 | 9.0 |
Cu2+ | 4.7 | 6.7 |
①步骤I中加入试剂A的目的是_____________________________,试剂A应选择______(填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因_____________________________________________________;
②步骤II中试剂B为_________,调节pH的范围是___________;
③步骤III的操作是加热浓缩、_______、___________。