题目内容
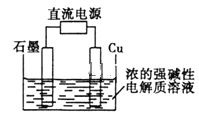
【题目】NaC1O3可用于制取二氧化氯、亚氯酸钠及高氯酸盐等。以原盐(主要成分为NaC1)为原料制备氯酸钠的工艺流程如下:

已知:Cr2O72-+H2O![]() 2CrO42-+2H+。
2CrO42-+2H+。
回答下列问题:
(1)“粗制盐水”中加入NaOH和Na2CO3的目的是___________________。
(2)过滤时,使用的玻璃仪器有烧杯、玻璃棒和____________。
(3)在pH:6.4~6.8,温度:40~50℃的条件下电解,理论上最终产物只有NaC1O3。电解时阳极的产物为C12,溶液中发生的反应有C12+H2O====HC1O+H++C1-,HC1O![]() H++C1O-和__________。
H++C1O-和__________。
(4)电解槽中温度不宜过高,其原因是_________________________。加入的Na2Cr2O7可以调节电解液酸度,若酸度过大,则电解液中主要存在__________(填“Cr2O72-”或“CrO42-”)。
(5)为检测电解后盐水中NaC1O3的物质的量浓度进行下列实验:
I.准确吸取10.00mL电解后的盐水,加入适量的3%H2O2溶液充分搅拌并煮沸。
Ⅱ.准确吸取0.10mol·L-1的(NH4)2Fe(SO4)2标准溶液25.00 mL于300mL锥形瓶中,加入足量稀硫酸。
III.将I的溶液加入Ⅱ的锥形瓶中,隔绝空气煮沸10min,加热充分反应。冷却至室温后,加入10mL0.4mol·L-1MnSO4溶液、5mL 85%磷酸溶液,用c mol·L-1的KMnO4标准溶液滴定剩余的Fe2+至溶液变为微红色,即滴定终点,此时消耗高锰酸钾V mL。
①步骤I中加入H2O2溶液的作用是______________________。
②步骤Ⅱ中C1O3-被Fe2+还原为C1-的离子方程式为________________________。
③该盐水中NaC1O3的物质的量浓度为________mol·L-1。
【答案】除去Mg2+和Ca2+ 漏斗 2HClO+ClO-=ClO3-+2Cl-+2H+ 防止HClO分解和Cl2逸出 Cr2O72- 除去电解后盐水中Cr2O72-和CrO42- ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O ![]()
【解析】
(1)根据流程,过滤得到盐泥,含Mg(OH)2和CaCO3,即加入NaOH和Na2CO3的目的是除去Mg2+和Ca2+;
(2)过滤时使用的玻璃仪器是漏斗、玻璃棒、烧杯,缺少的是漏斗;
(3)电解时阳极产物为Cl2,发生Cl2+H2O=HClO+H++Cl-、HClO![]() H++ClO-,根据题意,最终得到产物只有NaClO3,即只有HClO与ClO-发生氧化还原反应得到ClO3-,2HClO+ClO-=ClO3-+2Cl-+2H+;
H++ClO-,根据题意,最终得到产物只有NaClO3,即只有HClO与ClO-发生氧化还原反应得到ClO3-,2HClO+ClO-=ClO3-+2Cl-+2H+;
(4)根据问题(3),有Cl2和HClO,HClO受热易分解,要让氯气参与反应,应防止Cl2逸出,因此电解槽中的温度不宜过高的原因是防止HClO分解和Cl2逸出;根据Cr2O72-+H2O![]() 2CrO42-+2H+,酸度过大,c(H+)增大,该反应的平衡向逆反应方向进行,则电解液中主要以Cr2O72-形式存在;
2CrO42-+2H+,酸度过大,c(H+)增大,该反应的平衡向逆反应方向进行,则电解液中主要以Cr2O72-形式存在;
(5)①电解后的盐水中含有Cr2O72-和CrO42-,Cr2O72-和CrO42-具有强氧化性,能氧化Fe2+,干扰NaClO3的测定,因此加入H2O2的目的是除去电解后盐水中Cr2O72-和CrO42-;
②NaClO3具有强氧化性,能与Fe2+发生氧化还原反应,其离子方程式为ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
③KMnO4滴定剩余Fe2+,Fe2+被氧化成Fe3+,依据操作步骤,(NH4)2Fe(SO4)2作还原剂,NaClO3、KMnO4作氧化剂,根据得失电子数目守恒,有25.00×10-3L×0.10mol·L-1×1=n(NaClO3)×6+V×10-3L×cmol·L-1×5,解得:n(NaClO3)=(25×10-3×0.1-5V×10-3×c)/6mol,则c(NaClO3)=(25×10-3×0.1-5V×10-3×c)/(6×10×10-3)mol·L-1=![]() mol·L-1;
mol·L-1;

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】氧化二氯(C12O)是次氯酸的酸酐,用作氯化剂其部分性质如下:
物理性质 | 化学性质 |
常温下,C12O是棕黄色刺激性气体。 熔点:-120.6℃;沸点2.0℃ | C12O不稳定接触一般有机物易爆炸;它易溶于水,同时反应生成次氯酸。 |
实验室制备原理2Na2CO3+H2O+2Cl2![]() 2NaCl +2NaHCO3+ C12O, 现用下列装置设计实验制备少量C12O,并探究相关物质的性质。
2NaCl +2NaHCO3+ C12O, 现用下列装置设计实验制备少量C12O,并探究相关物质的性质。

(1)装置A中仪器X的名称为___________。
(2)若气体从左至右流动装置连接顺序是A、___________(每个装置限用一次)。
(3)装置F中盛装试剂的名称为___________。
(4)A中反应的离子方程式为___________。
(5)当D中收集适量液态物质时停止反应,设计简单实验证明B中残留固体中含有NaHCO3:___________。
(6)实验完成后取E中烧杯内溶液滴加品红溶液发现溶液褪色。该课题组设计实验探究溶液褪色的原因。
序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.1mol/LNaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
I | 5.0 | 0 | 0 | 5.0 | 3滴 | 较快褪色 |
II | 0 | 5.0 | a | 0 | 3滴 | 不褪色 |
III | 5.0 | 0 | 0 | 3滴 | 缓慢褪色 |
①a=___________。
②由上述实验得出的结论是___________。