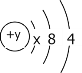题目内容
【题目】X、Y、Z、W、R为五种短周期主族元素,且原子序数依次增大,X与W同主族,Z与R同主族,X的原子半径比Y的小,Y的最高价氧化物对应的水化物是强酸,Z的最外层电子数是其内层电子数的3倍。下列说法正确的是
A. 原子半径:r(W)>r(Z)>r(Y)
B. 简单气态氢化物的热稳定性:Y>Z
C. R的氧化物对应的水化物均为强酸
D. W2Z2与X2R均含有共价键
【答案】D
【解析】
“Z的最外层电子数是其内层电子数的3倍”,因最外层电子数不越过8个,且第二周期元素的内层是K层,有2个电子,第三周期元素的内层是K、L层共10个电子,所以Z元素只能是第二周期的氧元素(核外K、L层电子数分别为2、6)。因“Z与R同主族”,故R为硫元素。因X、Y、Z、W、R原子序数依次增大,Y处于氧元素之前,且Y最高价氧化物对应的水化物是强酸,所以Y只能是氮元素。X处于Y之前且原子半径比Y小,所以X不会与Y周期(同周期元素原子半径逐渐减小),X且为主族,所以X只能是氢元素。W应处于氧与硫之间且与X同主族,所以W为钠元素。总之,X为氢、Y为氮、Z为氧、W为钠、R为硫。
A.根据同周期原子半径逐渐减小,同主族原子半径逐渐增大可知,原子半径大小关系为:r(Na)>r(N)>r(O)。A项错误;
B.根据元素非金属性越强,该元素气态氢化物的热稳定性越强可知,氢化物的热稳定性关系:H2O>NH3。B项错误;
C. 根据元素非金属性越强,该元素最高价氧化物对应的水化物的酸性越强,硫酸(H2SO4)是强酸,而亚硫酸(H2SO3)不是强酸,C项错误;
D.Na2O2的电子式为 ,过氧根中氧原子之间是共价键,H2S的电子式为
,过氧根中氧原子之间是共价键,H2S的电子式为![]() ,H与S之间是共价键,D项正确;答案选D。
,H与S之间是共价键,D项正确;答案选D。

【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向蔗糖中加入浓硫酸,搅拌得黑色海绵状固体,并放出刺激性气味气体 | 浓硫酸仅体现吸水性和脱水性 |
B | 向蓝色石蕊试纸上滴加新制氯水,试纸边缘呈红色,中间为白色 | 氯水既有酸性又有还原性 |
C | 卤代烃Y与NaOH溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀 | 卤代烃Y中含有氯原子 |
D | 取5 mL 0.1 mol·L-1KI溶液,加入1 mL 0.1 mol·L-1FeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变成血红色 | Fe3+与I-所发生的反应为可逆反应 |
A. A B. B C. C D. D