题目内容
【题目】室温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.050 0 mol·L-1H2C2O4溶液所得滴定曲线如图所示。下列关于溶液中微粒的物质的量浓度关系一定正确的是
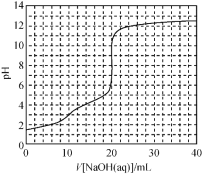
A. 在整个滴定过程中,始终存在:c(H+)+ c(Na+) =c(OH-)+c(C2O42-)+ c(HC2O4-)
B. 当V[NaOH(aq)]=10.00 mL时:c(Na+)> c(HC2O4-)>c(C2O42-)> c(H2C2O4)
C. 当V[NaOH(aq)]=15.00 mL时:3c(Na+)= 2c(C2O42-)+ 2c(HC2O4-)+2c(H2C2O4)
D. 当 V[NaOH(aq)]=30.00 mL时:c(C2O42-)+2c(HC2O4-)+3c(H2C2O4)=c(OH-)-c(H+)
【答案】BD
【解析】
A. 在整个滴定过程中,混合溶液中的溶质种类先后变化是H2C2O4和NaHC2O4,NaHC2O4、NaHC2O4和Na2C2O4,Na2C2O4、Na2C2O4和NaOH,不管是哪种情况,混合溶液中的离子种类始终只有H+、Na+、HC2O4-、C2O42-、OH-五种离子,所以整个滴定过程中电荷守恒关系有c(H+)+c(Na+)=c(OH-)+2c(C2O42-)+c(HC2O4-),A项错误;
B. 当V[NaOH(aq)]=10.00 mL时,溶液中NaOH与H2C2O4的物质的量之比为1:1,发生的反应为NaOH+H2C2O4=NaHC2O4+H2O,即所得溶液中的溶质为NaHC2O4,由图像知此时溶液显酸性,说明HC2O4-的电离程度大于其水解程度,HC2O4-![]() H++C2O42-,HC2O4-+H2O
H++C2O42-,HC2O4-+H2O![]() H2C2O4+OH-。所以溶液粒子浓度大小关系为c(Na+)> c(HC2O4-)>c(C2O42-)> c(H2C2O4),B项正确;
H2C2O4+OH-。所以溶液粒子浓度大小关系为c(Na+)> c(HC2O4-)>c(C2O42-)> c(H2C2O4),B项正确;
C. 当V[NaOH(aq)]=15.00 mL时,溶液中NaOH与H2C2O4的物质的量之比为3:2,发生反应3NaOH+2H2C2O4=NaHC2O4+ Na2C2O4+3H2O,所得溶液为等浓度的NaHC2O4和 Na2C2O4的混合溶液,根据物料守恒知混合溶液中钠元素与碳元素物质的量之比为3:4,则有c(Na+)=![]() [2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4)],即2c(Na+)=3c(C2O42-)+3c(HC2O4-)+3c(H2C2O4),C项错误;
[2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4)],即2c(Na+)=3c(C2O42-)+3c(HC2O4-)+3c(H2C2O4),C项错误;
D. 当 V[NaOH(aq)]=30.00 mL时,溶液中NaOH与H2C2O4的物质的量之比为3:1,发生反应2NaOH+H2C2O4= Na2C2O4+2H2O,所得溶液是等浓度的Na2C2O4和NaOH的混合溶液。由电荷守恒得c(H+)+c(Na+)=c(OH-)+2c(C2O42-)+c(HC2O4-),由物料守恒得c(Na+)= 3c(C2O42-)+3c(HC2O4-)+3c(H2C2O4),将两式中c(Na+)消去得:c(C2O42-)+2c(HC2O4-)+3c(H2C2O4)= c(OH-)-c(H+)。D项正确;答案选BD。

【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向蔗糖中加入浓硫酸,搅拌得黑色海绵状固体,并放出刺激性气味气体 | 浓硫酸仅体现吸水性和脱水性 |
B | 向蓝色石蕊试纸上滴加新制氯水,试纸边缘呈红色,中间为白色 | 氯水既有酸性又有还原性 |
C | 卤代烃Y与NaOH溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀 | 卤代烃Y中含有氯原子 |
D | 取5 mL 0.1 mol·L-1KI溶液,加入1 mL 0.1 mol·L-1FeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变成血红色 | Fe3+与I-所发生的反应为可逆反应 |
A. A B. B C. C D. D