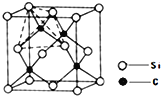
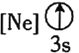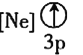题目内容
【题目】纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的![]() Fe3+还原,使Fe2+和Fe3+的物质的量比为1 : 2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:__________。
Fe3+还原,使Fe2+和Fe3+的物质的量比为1 : 2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:__________。
(2)电化学法也可制备纳米级Fe3O4,用面积为4 cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50 mA。生成Fe3O4的电极反应为______。
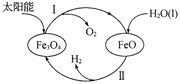
(3)已知:H2O(1) === H2(g)+![]() O2(g) △H =+285.5 kJ·mol-l,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。过程I:__________。过程Ⅱ:3FeO(s)+H2O(l) === H2(g)+Fe3O4(s) △H =+128.9 kJ·mol-1
O2(g) △H =+285.5 kJ·mol-l,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。过程I:__________。过程Ⅱ:3FeO(s)+H2O(l) === H2(g)+Fe3O4(s) △H =+128.9 kJ·mol-1
(4)磁铁矿(Fe3O4)常作冶铁的原料,主要反应为Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2 (g),该反应的△H < 0,T℃时,在1 L恒容密闭容器中,加入Fe3O4、CO各0.5 mol,10 min后反应达到平衡时,容器中CO2的浓度是0.4 mol·L-1。
3Fe(s)+4CO2 (g),该反应的△H < 0,T℃时,在1 L恒容密闭容器中,加入Fe3O4、CO各0.5 mol,10 min后反应达到平衡时,容器中CO2的浓度是0.4 mol·L-1。
①T℃时,10 min内用Fe3O4表示的平均反应速率为___g·min-1。
②T℃时,该反应的平衡常数为____________。
【答案】Fe2++2Fe3++8NH3·H2O === Fe3O4↓+8![]() +4H2O 3Fe-8e-+8OH-=== Fe3O4↓+2H2O 2Fe3O4(s) === 6FeO(s)+O2(g) △H =+313.2 kJ·mol-l 2.32 256
+4H2O 3Fe-8e-+8OH-=== Fe3O4↓+2H2O 2Fe3O4(s) === 6FeO(s)+O2(g) △H =+313.2 kJ·mol-l 2.32 256
【解析】
![]() 可以表示为
可以表示为![]() ,即
,即![]() 中铁的价态为既有+2价也有+3价,+2价和+3价的铁原子之比为1:2。
中铁的价态为既有+2价也有+3价,+2价和+3价的铁原子之比为1:2。
(1)![]() 和
和![]() 的物质的量比为1 : 2,加入氨水制得
的物质的量比为1 : 2,加入氨水制得![]() ,一水合氨是弱碱,离子方程式为:
,一水合氨是弱碱,离子方程式为:![]() ,
,
答案为:![]() ;
;
(2)不锈钢小球(铁)为阳极,失电子生成![]() ,且溶液为碱性环境,故电极方程式为:
,且溶液为碱性环境,故电极方程式为:![]() ,
,
答案为:![]() ;
;
(3)过程I为![]() 分解生成
分解生成![]() 和氧气,故化学方程式为:
和氧气,故化学方程式为: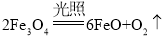 ,根据图像可以推知,整个过程为水分解生成氢气和氧气,即反应I和反应Ⅱ叠加得到总反应:
,根据图像可以推知,整个过程为水分解生成氢气和氧气,即反应I和反应Ⅱ叠加得到总反应:![]() △H1 =+285.5 kJ·mol-l,设反应Ⅱ焓变为△H2,则反应I的焓变为:
△H1 =+285.5 kJ·mol-l,设反应Ⅱ焓变为△H2,则反应I的焓变为:![]() ,故反应I的热化学方程式为:
,故反应I的热化学方程式为:![]() ,
,
故答案为:![]()
(4)①根据方程式![]() ,10 min后
,10 min后![]() 的浓度是0.4 mol·L-1,体积为1L,故
的浓度是0.4 mol·L-1,体积为1L,故![]() 的物质的量增加0.4mol,根据方程式
的物质的量增加0.4mol,根据方程式![]() 减少0.1mol(23.2g),故用Fe3O4表示的平均反应速率为
减少0.1mol(23.2g),故用Fe3O4表示的平均反应速率为![]() ,
,
故答案为:2.32 ;
②列三段式,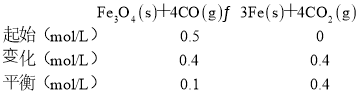 ,故平衡常数
,故平衡常数![]() ,
,
故答案为256。

 阅读快车系列答案
阅读快车系列答案【题目】I.根据表格信息,请回答下列问题:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
(1)反应①是________(填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式_______________________。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有____(填写字母序号)。
A.缩小反应容器的容积B.扩大反应容器的容积
C.升高温度D.使用合适的催化剂
E.设法减小平衡体系中的CO浓度
(5)若反应③的逆反应速率与时间的关系如图所示:
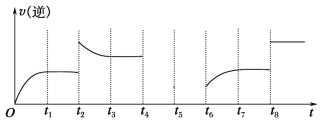
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时________;t8时________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。__________
Ⅱ.25℃,1.01×105Pa时,16g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式__________