题目内容
A、B、C、D、E、F是原子序数依次增大的短周期主族元素.A与D同主族、C与E同主族;B原子的最外层电子数是次外层电子数的2倍;D的原子序数是A的11倍,E的原子序数是C的原子序数的2倍.按要求回答下列问题:
(1)B原子的轨道表示式为 .D离子的电子排布式为 .
(2)由上述元素组成的化合物中属于极性键形成的非极性分子是(写出其中的任意两种,用化学式表示) 、 .
(3)A、B、D分别与F形成的化合物,熔沸点由低到高的顺序是(用化学式表示) .
(4)乙、丙是由上述元素组成的化合物,它们都含有四种元素,其中乙、丙所含的元素种类完全相同.若将乙、丙形成的溶液相混合,有刺激性气味的气体生成,将该气体通入到F单质形成的水溶液中,生成两种强酸.试写出有关离子方程式:
①乙、丙形成的溶液相混合 ;
②刺激性气味气体通入F单质形成的水溶液中 .
(1)B原子的轨道表示式为
(2)由上述元素组成的化合物中属于极性键形成的非极性分子是(写出其中的任意两种,用化学式表示)
(3)A、B、D分别与F形成的化合物,熔沸点由低到高的顺序是(用化学式表示)
(4)乙、丙是由上述元素组成的化合物,它们都含有四种元素,其中乙、丙所含的元素种类完全相同.若将乙、丙形成的溶液相混合,有刺激性气味的气体生成,将该气体通入到F单质形成的水溶液中,生成两种强酸.试写出有关离子方程式:
①乙、丙形成的溶液相混合
②刺激性气味气体通入F单质形成的水溶液中
分析:B原子的最外层电子数是次外层电子数的2倍,若有2个电子层,则B为碳元素,3个电子层不符合题意;D的原子序数是A的11倍,A与D同主族,则A为氢元素、D为钠元素;E的原子序数是C的原子序数的2倍,C与E同主族,则C为氧元素、E为硫元素;A、B、C、D、E、F是原子序数依次增大的短周期主族元素,则F为氯元素;
(1)利用碳的电子数及电子排布的规律来书写轨道表示式,利用钠原子失去1个电子变为钠离子来分析离子的电子排布式;
(2)极性键是两种不同非金属元素形成,非极性分子的结构对称,正负电荷的中心重合;
(3)利用晶体的类型来分析物质的熔沸点,分子晶体的熔沸点利用相对分子质量来判断;
(4)乙、丙都含有四种元素,其中乙、丙所含的元素种类完全相同,溶液相混合时有刺激性气味的气体生成,将该气体通入到F单质形成的水溶液中,生成两种强酸,则刺激性气味的气体为二氧化硫,则乙、丙可能为NaHSO3、NaHSO4,然后书写有关的离子方程式.
(1)利用碳的电子数及电子排布的规律来书写轨道表示式,利用钠原子失去1个电子变为钠离子来分析离子的电子排布式;
(2)极性键是两种不同非金属元素形成,非极性分子的结构对称,正负电荷的中心重合;
(3)利用晶体的类型来分析物质的熔沸点,分子晶体的熔沸点利用相对分子质量来判断;
(4)乙、丙都含有四种元素,其中乙、丙所含的元素种类完全相同,溶液相混合时有刺激性气味的气体生成,将该气体通入到F单质形成的水溶液中,生成两种强酸,则刺激性气味的气体为二氧化硫,则乙、丙可能为NaHSO3、NaHSO4,然后书写有关的离子方程式.
解答:解:由B原子的最外层电子数是次外层电子数的2倍,若有2个电子层,则B为碳元素,3个电子层不符合题意;D的原子序数是A的11倍,A与D同主族,则A为氢元素、D为钠元素;E的原子序数是C的原子序数的2倍,C与E同主族,则C为氧元素、E为硫元素;A、B、C、D、E、F是原子序数依次增大的短周期主族元素,则F为氯元素;
(1)因B为碳元素,其电子数为6,则B原子的轨道表示式为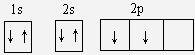 ,D为钠元素,其电子数为11,变为钠离子时失去最外层1个电子,则钠离子的电子排布式为1S22S22p6,故答案为:
,D为钠元素,其电子数为11,变为钠离子时失去最外层1个电子,则钠离子的电子排布式为1S22S22p6,故答案为: ;1S22S22p6;
;1S22S22p6;
(2)因碳与氧之间、碳与氢之间形成的共价键为极性键,且CO2、CH4分子的结构对称,正负电荷的中心重合,则CO2、CH4为非极性分子,故答案为:CO2;CH4;(CCl4或CS2等均可)
(3)因A、B、D分别与F形成的化合物为HCl、CCl4、NaCl,氯化钠为离子晶体,三种物质中熔沸点最高,另两种物质为分子晶体,相对分子质量大的熔沸点高,即它们的熔沸点由低到高的顺序为HCl<CCl4<NaCl,故答案为:HCl<CCl4<NaCl;
(4)乙、丙都含有四种元素,其中乙、丙所含的元素种类完全相同,溶液相混合时有刺激性气味的气体生成,将该气体通入到F单质形成的水溶液中,生成两种强酸,则刺激性气味的气体为二氧化硫,则乙、丙可能为NaHSO3、NaHSO4,①混合时发生的离子反应为HSO3-+H+═H2O+SO2↑;
②二氧化硫和氯气和水反应生成硫酸和盐酸,其离子反应为SO2+2H2O+Cl2═4H++SO42-+2Cl-,故答案为:HSO3-+H+═H2O+SO2↑;SO2+2H2O+Cl2═4H++SO42-+2Cl-.
(1)因B为碳元素,其电子数为6,则B原子的轨道表示式为
 ,D为钠元素,其电子数为11,变为钠离子时失去最外层1个电子,则钠离子的电子排布式为1S22S22p6,故答案为:
,D为钠元素,其电子数为11,变为钠离子时失去最外层1个电子,则钠离子的电子排布式为1S22S22p6,故答案为: ;1S22S22p6;
;1S22S22p6;(2)因碳与氧之间、碳与氢之间形成的共价键为极性键,且CO2、CH4分子的结构对称,正负电荷的中心重合,则CO2、CH4为非极性分子,故答案为:CO2;CH4;(CCl4或CS2等均可)
(3)因A、B、D分别与F形成的化合物为HCl、CCl4、NaCl,氯化钠为离子晶体,三种物质中熔沸点最高,另两种物质为分子晶体,相对分子质量大的熔沸点高,即它们的熔沸点由低到高的顺序为HCl<CCl4<NaCl,故答案为:HCl<CCl4<NaCl;
(4)乙、丙都含有四种元素,其中乙、丙所含的元素种类完全相同,溶液相混合时有刺激性气味的气体生成,将该气体通入到F单质形成的水溶液中,生成两种强酸,则刺激性气味的气体为二氧化硫,则乙、丙可能为NaHSO3、NaHSO4,①混合时发生的离子反应为HSO3-+H+═H2O+SO2↑;
②二氧化硫和氯气和水反应生成硫酸和盐酸,其离子反应为SO2+2H2O+Cl2═4H++SO42-+2Cl-,故答案为:HSO3-+H+═H2O+SO2↑;SO2+2H2O+Cl2═4H++SO42-+2Cl-.
点评:本题考查知识点较多,注重了元素周期表和元素周期律与元素化合物知识的综合,学生应熟悉位置、结构、性质的关系来推断元素,并熟悉物质的性质来解答即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.