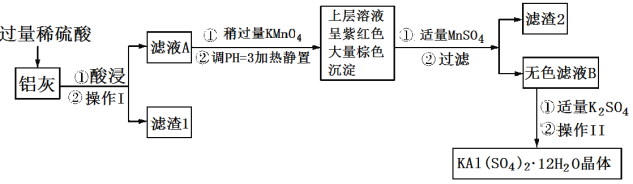
题目内容
【题目】下图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现![]() 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通![]() 后,使c、d两点短路.下列叙述正确的是
后,使c、d两点短路.下列叙述正确的是
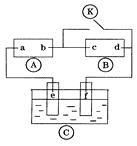
A. a为直流电源的负极
B. c极发生的反应为2H++2e-=H2↑
C. f电极为锌板
D. e极发生还原反应
【答案】B
【解析】A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后发现B上的c点显红色,
则c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,d电极上氯离子放电生成氯气,则a是直流电源正极,b是直流电源负极;
为实现铁上镀锌,接通K后,使c、d两点短路,e是电解池阳极,f是阴极,电镀时,镀层作阳极,镀件作阴极,
A.通过以上分析知,a是直流电源正极,故A错误;
B.接通K前,c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,则c极发生的反应为2H++2e﹣═H2↑,故B正确;
C.为实现铁上镀锌,锌作阳极,铁作阴极,所以e电极为锌板,故C错误;
D.e电极是阳极,阳极上失电子发生氧化反应,故D错误.
故选B.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
(1)该反应的离子方程式为 __________________________________ .
实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01molL-1、0.001molL-1,每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1molL-1)的用量均为2mL.在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液的浓度/molL-1 | 溶液褪色所需时间t/min | ||
第1次 | 第2次 | 第3次 | |
0.01 | 14 | 13 | 11 |
0.001 | 6 | 7 | 7 |
(2)计算用0.001molL-1KMnO4酸性溶液进行实验时KMnO4的平均反应速率___________________________ (忽略混合前后溶液的体积变化).
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行? _____________________ .(填“行”或“不行”)