题目内容
【题目】(以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2 , 负极通入丙烧,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2═3CO2+4H2O.
(1)已知:2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H1C(s)+O2(g)═CO2(g)△H2
2C(s)+O2(g)═2CO(g)△H3
则 C3H8(g)+5O2((g)═3CO2(g)+4H2O(l)△H=(用△H1、△H2、△H3表示)
(2)写出该电池正极的电极反应式:,电池工作时CO32﹣移向(填“正极”或“负极”);用该电池电解1000mL lmol/L的AgNO3溶液(惰性电极),此电解池的反应方程式为 .
【答案】
(1)![]() △H1+3△H2﹣
△H1+3△H2﹣ ![]() △H3
△H3
(2)负极;4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3
4Ag+O2↑+4HNO3
【解析】解:(1)已知:①2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H1
②C(s)+O2(g)═CO2(g)△H2
③2C(s)+O2(g)═2CO(g)△H3
依据盖斯定律:①× ![]() +②×3﹣③×
+②×3﹣③× ![]() 得到:C3H8(g)+5O2((g)═3CO2(g)+4H2O(l)△H=(
得到:C3H8(g)+5O2((g)═3CO2(g)+4H2O(l)△H=( ![]() △H1+3△H2﹣
△H1+3△H2﹣ ![]() △H3)
△H3)
所以答案是: ![]() △H1+3△H2﹣
△H1+3△H2﹣ ![]() △H3;(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融的碳酸盐.电池反应方程式为C3H8+5O2=3CO2+4H2O;正极发生还原反应,反应式为:O2+2CO2+4e﹣=2 CO32﹣;原电池中的阴离子向负极移动,放电时CO32﹣移向电池的负极,惰性电极电解1000mL1mol/L的AgNO3溶液,阳极电极反应为4OH﹣4e﹣=2H2O+O2↑,阴极电极反应为:4Ag++4e﹣=4Ag,电解池的总反应方程式为:4AgNO3+2H2O
△H3;(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融的碳酸盐.电池反应方程式为C3H8+5O2=3CO2+4H2O;正极发生还原反应,反应式为:O2+2CO2+4e﹣=2 CO32﹣;原电池中的阴离子向负极移动,放电时CO32﹣移向电池的负极,惰性电极电解1000mL1mol/L的AgNO3溶液,阳极电极反应为4OH﹣4e﹣=2H2O+O2↑,阴极电极反应为:4Ag++4e﹣=4Ag,电解池的总反应方程式为:4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3,
4Ag+O2↑+4HNO3,
所以答案是:O2+2CO2+4e﹣=2 CO32﹣;负极;4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3.
4Ag+O2↑+4HNO3.

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】[化学一一选修3:物质结构与性质]碳族元素的单质和化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)锗是重要半导体材料,基态Ge原子中,核外电子占据最高能级的符号是__________,该能级的电子云轮廓图为______________。金属Ge晶胞结构与金刚石类似,质地硬而脆,沸点2830℃,锗晶体属于__________晶体。
(2)①(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为______________,(CH3)3C+中碳骨架的几何构型为____________________。
②治疗铅中毒可滴注依地酸钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_______(填标号)
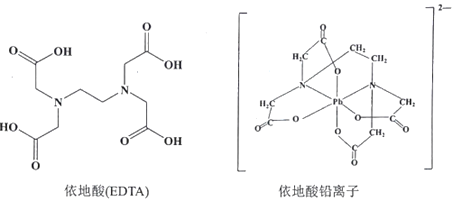
A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(3)下表列出了碱土金属碳酸盐的热分解温度和阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
碱土金属碳酸盐同主族由上到下的热分解温度逐渐升高,原因是:__________________________。
(4)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图:
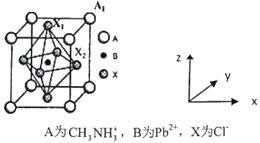
①若该晶胞的边长为anm,则Cl-间的最短距离是____________________。
②在该晶胞的另一种表达方式中,若图中Pb2+处于顶点位置,则Cl-处于_________位置。原子坐标参数B为(0,0,0);A1为(1/2,1/2,1/2),则X2为_________________。