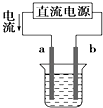
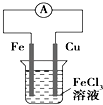
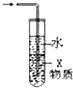题目内容
【题目】下列气体有颜色的是
A.O2 B.Cl2 C.NH3 D.NO
【答案】B
【解析】
试题分析:氧气、氨气、NO均是无色气体,氯气是黄绿色气体,答案选B。

【题目】汽车尾气作为空气污染的主要来源之一,其中含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等.为汽车尾气的治理,环境工作者面临着巨大的挑战.试回答以下问题: 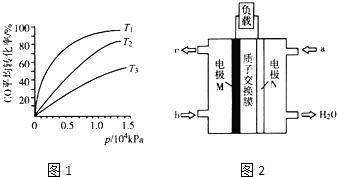
(1)用CH4催化还原NO,可以消除氮氧化物的污染.已知: ①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJmol﹣1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJmol﹣1
由CH4将NO2完全还原成N2 , 生成CO2和水蒸气的热化学方程式是 .
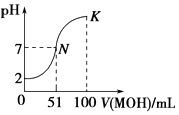
(2)NOx也可以被NaOH溶液吸收而生成NaNO3、NaNO2 , 已知某温度下,HNO2的电离常数K=﹣9.7×10﹣4 , NO2﹣的水解常数K=﹣8.0×10﹣10 , 则该温度下水的离子积常数=(用含Ka、Kb的代数式表示),此时溶液的温度25℃(填“>”“<”或“=”).
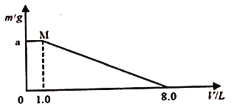
(3)化工上利用CO合成甲醇,反应的热化学方程式为CO(g)+2H2(g)CH3OH(g)△H=﹣90.8kJmol﹣1 . 不同温度下,CO的平衡转化率与压强的关系如图1所示,图中T1、T2、T3的高低顺序是 , 理由是 .
(4)化工上还可以利用CH3OH生产CH3OCH3 . 在体积均为1.0L的恒容密闭容器中发生反应2CH3OH(g)CH3OCH3(g)+H2O(g).
容器换号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH2(g) | H2O(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
该反应的正反应为反应(填“放热”或“吸热”).若起始时向容器I中充入CH3OH 0.15mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向方向进行(填“正”或“逆”).
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用.已知电池工作时的总反应方程式为2CH3OH+3O2═2CO2+4H2O,电池工作时的示意图如图2所示.质子穿过交换膜移向电极区(填“M”或“N”),负极的电极反应式为 .