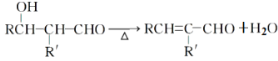题目内容
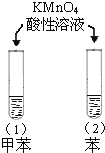
【题目】利用如图所示的实验装置和方法进行实验,能达到目的的是( )
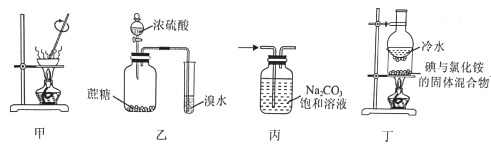
A.甲装置可将AlCl3溶液蒸干获得AlCl3晶体
B.乙装置可证明浓硫酸具有脱水性和氧化性
C.丙装置可除去CO2中的HCl
D.丁装置可将NH4Cl固体中的I2分离
【答案】B
【解析】
A. AlCl3溶液加热会强烈水解,生成氢氧化铝和氯化氢,氯化氢挥发又促进水解,蒸干后获得氢氧化铝,不能获得氯化铝晶体,故A错误;
B. 浓硫酸可以脱去蔗糖中的水,即“黑面包实验”,同时硫酸被还原得到二氧化硫,二氧化硫使溴水褪色,因此体现了浓硫酸的脱水性和氧化性,故B正确;
C. 碳酸钠溶液会吸收二氧化碳变成碳酸氢钠,因此不能用来除去二氧化碳中的HCl,故C错误;
D. 氯化铵固体受热分解成的氨气和氯化氢遇冷后会重新化合成氯化铵,碘受热易升华,两者都重新附着于圆底烧瓶底部无法分离,故D错误;
故选:B。

【题目】下列根据实验及现象得出的结论不正确的是
实验 | 现象 | 结论 | |
A |
| 试管(1)中紫色消失,试管(2)中紫色没有消失 | 甲苯中苯环使甲基的活性增强 |
B |
| 试管内壁有银镜生成 | X具有还原性,一定含有醛基 |
C |
| 先生成白色沉淀,滴加FeCl3溶液后,生成红褐色沉淀 | Fe(OH)3 是比Mg(OH)2 更难溶的电解质 |
D |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
A.AB.BC.CD.D
【题目】在2 L密闭容器内,800 ℃时,0.02molNO(g)和0.01molO2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应_____(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为_______。
(2)如图中表示NO2变化曲线的是________,用O2表示从0~2 s内该反应的平均速率v=________。
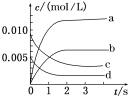
(3)能说明该反应已达到平衡状态的是________。
a v(NO2)=2v(O2) b 容器内压强保持不变
c v逆(NO)=2v正(O2) d 容器内密度保持不变
【题目】下表是元素周期表的一部分,已知X元素的最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径在其所处的族中最小。
B | ||
A | X | C |
D |
请回答下列问题:
(1)X的元素符号是___________。
(2)D元素的最高正化合价是_______________。
(3)写出C的气态氢化物的电子式__________________________。
(4)写出工业上合成B的气态氢化物的化学方程式___________________________。