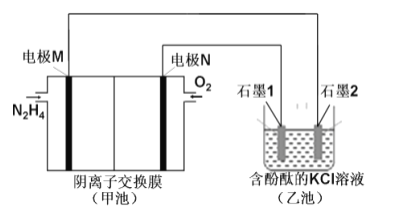
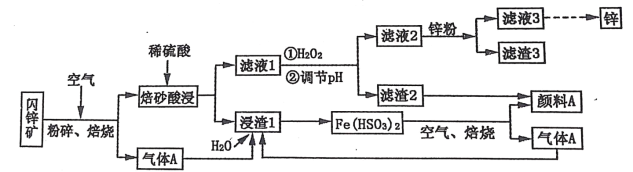
题目内容
【题目】氯化亚铜是一种无机精细化工产品,实验室用蚀刻废液![]() 主要含
主要含![]() 、HCl等
、HCl等![]() 制备CuCl的实验流程如下.
制备CuCl的实验流程如下.
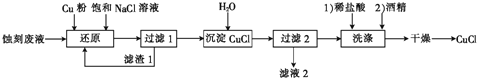
![]() 滤渣1的主要成分为 ______ ;还原时生成
滤渣1的主要成分为 ______ ;还原时生成![]() 的离子方程式为 ______ .
的离子方程式为 ______ .
![]() 加水时发生反应的离子方程式为 ______
加水时发生反应的离子方程式为 ______ ![]() 过滤时用的硅酸盐质仪器除烧杯外还有 ______
过滤时用的硅酸盐质仪器除烧杯外还有 ______ ![]() 滤液2的用途是 ______ .
滤液2的用途是 ______ .
![]() 用稀盐酸洗涤的目的是 ______ .
用稀盐酸洗涤的目的是 ______ .
【答案】铜粉 ![]()
![]() 漏斗和玻璃棒 返回到还原步骤,循环利用 减少CuCl溶解损失
漏斗和玻璃棒 返回到还原步骤,循环利用 减少CuCl溶解损失
【解析】
根据题中的流程可知,蚀刻废液![]() 主要含
主要含![]() 、HCl等
、HCl等![]() 中加入足量的铜粉及饱和氯化钠溶液,铜将
中加入足量的铜粉及饱和氯化钠溶液,铜将![]() 还原成
还原成![]() ,过滤掉未反应的铜粉,所以滤渣1为未反应的铜粉,在滤液中加足量的水,
,过滤掉未反应的铜粉,所以滤渣1为未反应的铜粉,在滤液中加足量的水,![]() 电离出氯离子得CuCl沉淀,过滤后将CuCl沉淀用稀盐酸洗涤,主要是减小CuCl在水中的溶解度,再用酒精洗涤,酒精易挥发,便于干燥,得到CuCl,滤液2中含有氯化钠和盐酸,可循环利用,据此答题。
电离出氯离子得CuCl沉淀,过滤后将CuCl沉淀用稀盐酸洗涤,主要是减小CuCl在水中的溶解度,再用酒精洗涤,酒精易挥发,便于干燥,得到CuCl,滤液2中含有氯化钠和盐酸,可循环利用,据此答题。
![]() 根据上面的分析可知,滤渣1的主要成分为铜粉,根据元素守恒和电荷守恒可知,还原时生成
根据上面的分析可知,滤渣1的主要成分为铜粉,根据元素守恒和电荷守恒可知,还原时生成![]() 的离子方程式为
的离子方程式为![]() , 故答案为:铜粉;
, 故答案为:铜粉;![]() ;
;
![]() 加水时发生反应的离子方程式为
加水时发生反应的离子方程式为![]() ,过滤时用的硅酸盐质仪器除烧杯外还有漏斗和玻璃棒,滤液2中含有氯化钠和盐酸,所以滤液2的用途是返回到还原步骤,循环利用, 故答案为:
,过滤时用的硅酸盐质仪器除烧杯外还有漏斗和玻璃棒,滤液2中含有氯化钠和盐酸,所以滤液2的用途是返回到还原步骤,循环利用, 故答案为:![]() ;漏斗和玻璃棒;返回到还原步骤,循环利用;
;漏斗和玻璃棒;返回到还原步骤,循环利用;
![]() 根据上面的分析可知,用稀盐酸洗涤的目的是减少CuCl溶解损失, 故答案为:减少CuCl溶解损失。
根据上面的分析可知,用稀盐酸洗涤的目的是减少CuCl溶解损失, 故答案为:减少CuCl溶解损失。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】根据要求完成下列各小题:
Ⅰ.(1)理论上稀的强酸、强碱反应生成1molH2O(l)时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式__________________________。
(2)已知:乙苯催化脱氢制苯乙烯反应:![]() +H2(g)
+H2(g)
化学键 | C-H | C-C | C=C | H-H |
键能/kJmol-1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=_________kJmol-1。
Ⅱ.25℃时,部分物质的电离平衡常数如表所示,请回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为_____________________________。
(2)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:____________________。