��Ŀ����
����Ŀ����������������Ԫ�أ����ܻ�������Ϊ���ϣ������ƾõ���ʷ���ڻ�е���졢���Բ��ϵ�����Ҳ���й㷺��Ӧ�ã���ش���������:
��1��Co��̬ԭ�ӵĵ����Ų�ʽΪ_____��
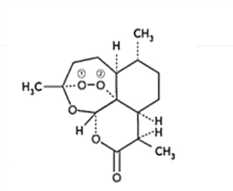
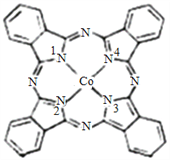
��2��̪ݼ�ܽ������ڹ����ϡ������Թ�ѧ���ϡ����ѧ�еĹ������������ȷ���õ��㷺��Ӧ�ã���ṹ��ͼ��ʾ����������Ϊ�����ӡ�
��̪ݼ�������ַǽ���ԭ�ӵĵ縺���д�С��˳��Ϊ_________ (����Ӧ��Ԫ�ط�������)��̼ԭ�ӵ��ӻ��������Ϊ__________��
����������ͨ����λ����ϵĵ�ԭ�ӵı����_____________��
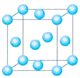
��3��Co��һ��������ľ�����ͼ��ʾ���ڸþ�������һ����ԭ�ӵȾ������������ԭ����______������֪�ڸ��ܵ������ᄃ������ԭ�ӵİ뾶Ϊapm����ԭ�ӵİ뾶Ϊbpm�������ھ������ǽ��ܽӴ��ģ����ڸ��ܵ������ᄃ����ԭ�ӵĿռ�������Ϊ____(�ú�a��b��ʽ�ӱ�ʾ)��
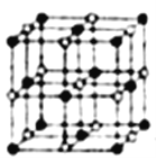
��4���������Ͽ�ѧ����ʵ����һ������С�鷢������5K�³��ֳ����Եľ��壬�þ������CoO2�IJ�״�ṹ(����ͼ��ʾ��С���ʾCoԭ�ӣ������ʾOԭ��)�������ô��������ظ��ṹ��Ԫʾ��ͼ�У���������CoO2�Ļ�ѧ��ɵ���_______��
 ��
��
���𰸡� 1s22s22p63s23p63d74s2 N>C>H sp2 2��4 6 ![]() D
D
��������������CoΪ27��Ԫ�أ�Ԫ�صķǽ�����Խǿ����縺��Խ����Nԭ�ӳɼ�����ж����Ƿ�����γ���λ�������ݾ����ṹȷ����λ�������ݾ�����ԭ�ӵ�������;����������ԭ�ӵĿռ������ʣ����ݾ�̯����ԭ�Ӹ����������뻯ѧʽ�Ƚϡ�
��⣺��1��Co��̬ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d74s2 ��
��2����̪ݼ�������ַǽ���ԭ�ӵĵ縺���д�С��˳��ΪN>C>H���ɷ��ӽṹʾ��ͼ��֪������������̼ԭ�ӵ��ӻ�������;�Ϊsp2��
����ͼ��֪�����Ϊ1��3��Nԭ��ǡ���γ�3���Ҽ��������Ϊ2��4��Nԭ�ӳ��γ�3���Ҽ��⣬���ֱ��γ���һ���м�������Nԭ�ӵļ۵�������5�������γ�3���Ҽ�����۲���Ӿʹﵽ����ȶ��Ľṹ������������ͨ����λ����ϵĵ�ԭ�ӵı����2��4 ��
��3���ɾ����ṹʾ��ͼ��֪���þ������Ȼ��ƾ���ľ������ƣ��ڸþ���������ԭ�ӵ���λ����Ϊ6������һ����ԭ�ӵȾ������������ԭ����6������������֪�ڸ��ܵ������ᄃ������ԭ�ӵİ뾶Ϊapm����ԭ�ӵİ뾶Ϊbpm�������ھ������ǽ��ܽӴ��ģ���þ����ı߳�Ϊ(2a+2b)pm�����������Ϊ(2a+2b)3pm3���þ�������4��Co��4��O��4��Co��4��O�������Ϊ![]() �����ԣ����ܵ������ᄃ����ԭ�ӵĿռ�������Ϊ
�����ԣ����ܵ������ᄃ����ԭ�ӵĿռ�������Ϊ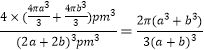 ��
��
��4����CoO2�IJ�״�ṹʾ��ͼ��֪��A����������Oԭ����Ϊ4![]() ��Coԭ����Ϊ1��B����������Oԭ����Ϊ4��Coԭ����Ϊ4
��Coԭ����Ϊ1��B����������Oԭ����Ϊ4��Coԭ����Ϊ4![]() ��C����������Oԭ����Ϊ4
��C����������Oԭ����Ϊ4![]() ��Coԭ����Ϊ2
��Coԭ����Ϊ2![]() ��D����������Oԭ����Ϊ4
��D����������Oԭ����Ϊ4![]() ��Coԭ����Ϊ1�������������ô��������ظ��ṹ��Ԫʾ��ͼ������������CoO2�Ļ�ѧ��ɵ���D��
��Coԭ����Ϊ1�������������ô��������ظ��ṹ��Ԫʾ��ͼ������������CoO2�Ļ�ѧ��ɵ���D��