题目内容
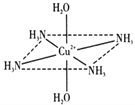
【题目】(一)往硫酸铜水溶液中加入氨水,首先生成难溶物,继续加氨水,难溶物溶解,而且所得溶液的颜色比原来明显加深,得到了一种含2+的溶液,此离子的立体结构如图所示(4个NH3与Cu2+共面,跟H2O﹣Cu2+﹣H2O轴线垂直).请回答以下问题:
(1)硫酸铜水溶液加氨水的变化过程,用离子方程式表示为生成深蓝色溶液:__________.
(2)此深蓝色的离子中Cu2+与H2O和NH3形成的是________键,请在图中表示此化学键________.此深蓝色离子的空间结构呈________形.
(二).由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:Na2O+Cl2=2NaCl+O2、CaO+Cl2=CaCl2+O2、SiO2+2CCl4=SiCl4+2COCl2、Cr2O3+3CCl4=2CrCl3+3COCl2。请回答下列问题:
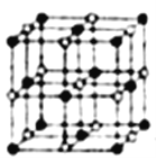
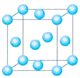
⑴与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有______(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为_____。
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键,其中碳氧原子之间共价键是____(填序号)
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为_________。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3401kJmol-1、NaCl-786kJmol-1。导致两者晶格能差异的主要原因是_____________________________________________。

【答案】 Cu(OH)2+4NH3H2O=[Cu(NH3)4(H2O)2]2++2OH﹣+2H2O 配位 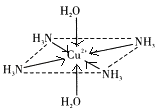 八面体 K、Cu 4 c 6 CaO晶体中离子的电荷数大于NaCl
八面体 K、Cu 4 c 6 CaO晶体中离子的电荷数大于NaCl
【解析】分析:(一)(1)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀;当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,据此书写离子方程式;
(2)配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键,据此标出化学键;根据题干信息分析微粒的空间构型;
(二)(1)Cr是24号元素,在第四周期,核外有24个电子分四层排布;Cr最外层有1个电子;利用均摊法计算;
(2)光气分子中C原子采取sp2杂化成键,C原子与氯原子之间形成C-Cl单键,故C原子与O原子之间形成C=O双键,据此判断;
(3)由CaO晶胞结构可知,CaO晶体中每个O2-的周围有6个Ca2+,每个Ca2+的周围有6个O2-,影响晶格能的因素有离子所带电荷与离子半径,据此解答。
详解:(一)(1)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,继续滴加氨水,氨水和浅蓝色氢氧化铜反应生成可溶性的铜氨络合物,根据离子的立体结构可知生成[Cu(NH3)4(H2O)2]2+离子,所以发生的离子反应为Cu(OH)2+4NH3H2O=[Cu(NH3)4(H2O)2]2++2OH﹣+2H2O;
(2)硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,继续加氨水时,氢氧化铜和氨水继续反应,Cu2+提供空轨道,N原子提供孤对电子,生成络合物而使溶液澄清,[Cu(NH3)4(H2O)2]2+为配离子,Cu2+提供空轨道,N、O原子提供孤对电子,则以配位键结合,因此化学键可表示为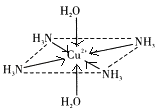 ;[Cu(NH3)4(H2O)2]2+为配离子,4个NH3与Cu2+共面,跟H2O-Cu2+-H2O轴线垂直,铜离子的配位数是6,将6个分子连接后所围成的空间几何构型八面体;
;[Cu(NH3)4(H2O)2]2+为配离子,4个NH3与Cu2+共面,跟H2O-Cu2+-H2O轴线垂直,铜离子的配位数是6,将6个分子连接后所围成的空间几何构型八面体;
(二):(1)Cr是24号元素,在第四周期,核外有24个电子分四层排布,Cr最外层有1个电子,因此与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu;该金属原子位于顶点和面心上,则晶胞中含有金属原子的数目为8×1/8+6×1/2=4;
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键,C原子与氯原子之间形成C-Cl单键,故C原子与O原子之间形成C=O双键,C=O双键中含有1个σ键、1个π键,答案选c;
(3)由CaO晶胞结构可知,CaO晶体中每个O2-的周围有6个Ca2+,每个Ca2+的周围有6个O2-;影响离子晶体晶格能差异的因素是离子半径和离子所带电荷数,因此导致两者晶格能差异的主要原因是CaO晶体中离子的电荷数大于NaCl晶体中离子的电荷数。

 阅读快车系列答案
阅读快车系列答案