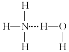题目内容
【题目】青蒿素是从黄花蒿中提取的一种无色针状晶体,双氢青蒿素是青蒿素的重要衍生物,抗疟疾疗效优于青蒿素,请回答下列问题:

(1)组成青蒿素的三种元素电负性由大到小排序是__________,画出基态O原子的价电子排布图__________。
(2)一个青蒿素分子中含有_______个手性碳原子。
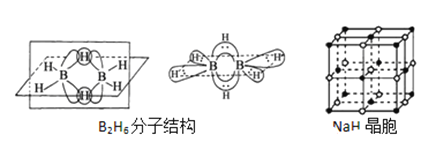
(3)双氢青蒿素的合成一般是用硼氢化钠(NaBH4)还原青蒿素.硼氢化物的合成方法有: 2LiH+B2H6=2LiBH4; 4NaH+BF3═NaBH4+3NaF
①写出BH4﹣的等电子体_________(分子、离子各写一种);
②B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心二电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子.则B2H6分子中有______种共价键;
③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是______________;
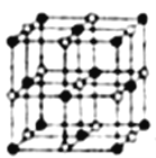
④NaH的晶胞如图,则NaH晶体中阳离子的配位数是_________;设晶胞中阴、阳离子为刚性球体且恰好相切,求阴、阳离子的半径比![]() =__________由此可知正负离子的半径比是决定离子晶体结构的重要因素,简称几何因素,除此之外影响离子晶体结构的因素还有_________、_________。
=__________由此可知正负离子的半径比是决定离子晶体结构的重要因素,简称几何因素,除此之外影响离子晶体结构的因素还有_________、_________。
【答案】 O>C>H ![]() 7 CH4、NH4+ 2 B原子价电子层上没有d轨道,Al原子价电子层上有d轨道 6 0.414 电荷因素 键性因素
7 CH4、NH4+ 2 B原子价电子层上没有d轨道,Al原子价电子层上有d轨道 6 0.414 电荷因素 键性因素
【解析】分析:非金属性越强的元素,其电负性越大;根据原子核外电子排布的3大规律分析其电子排布图;手性碳原子上连着4个不同的原子或原子团;等电子体之间原子个数和价电子数目均相同;配合物中的配位数与中心原子的半径和杂化类型共同决定;根据晶胞结构、配位数、离子半径的相对大小画出示意图计算阴、阳离子的半径比。
详解:(1)组成青蒿素的三种元素是C、H、O,其电负性由大到小排序是O>C>H,基态O原子的价电子排布图![]() 。
。
(2)一个青蒿素分子中含有7个手性碳原子,如图所示: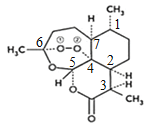 。
。
(3)①根据等电子原理,可以找到BH4﹣的等电子体,如CH4、NH4+;
②B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心2电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子.则B2H6分子中有B—H键和3中心2电子键等2种共价键;
③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是:B原子的半径较小、价电子层上没有d轨道,Al原子半径较大、价电子层上有d轨道;
④由NaH的晶胞结构示意图可知,其晶胞结构与氯化钠的晶胞相似,则NaH晶体中阳离子的配位数是6;设晶胞中阴、阳离子为刚性球体且恰好相切,Na+半径大于H-半径,两种离子在晶胞中的位置如图所示: 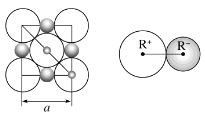 。Na+半径的半径为对角线的
。Na+半径的半径为对角线的![]() ,对角线长为
,对角线长为![]() ,则Na+半径的半径为
,则Na+半径的半径为![]() ,H-半径为
,H-半径为![]() ,阴、阳离子的半径比
,阴、阳离子的半径比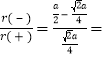 0.414。由此可知正负离子的半径比是决定离子晶体结构的重要因素,简称几何因素,除此之外影响离子晶体结构的因素还有电荷因素(离子所带电荷不同其配位数不同)和键性因素(离子键的纯粹程度)。
0.414。由此可知正负离子的半径比是决定离子晶体结构的重要因素,简称几何因素,除此之外影响离子晶体结构的因素还有电荷因素(离子所带电荷不同其配位数不同)和键性因素(离子键的纯粹程度)。