题目内容
【题目】(1) ① 25℃时,NH4Cl溶液呈酸性,原因是______水解引起的(填“NH4+”或“Cl-”);
② 常温下,0.0100mol/L NaOH溶液的pH=___________;
③ 用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为_______(填“蓝色”或“无色”),且半分钟内颜色保持不变。
④ 已知在25℃:AgCl(s) ![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10
Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50
向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_________(填“AgCl”或“Ag2S”)。
(2)已知25℃合成氨反应中,1mol N2完全转化为NH3时释放的能量为92.4 kJ。现将1mol N2和3mol H2混合置于2L密闭容器中,反应进行到2s末测得NH3为0.4mol。
回答下列:
① 该反应的热化学方程式是______________ ;
② 该反应达到平衡后,升高温度平衡向_______ (填“正”、“逆”)反应方向移动;加入催化剂平衡________(填“正”、“逆”、 “不”)移动;
③ 前2s内v(H2)是___________。
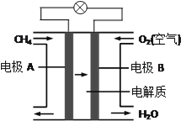
(3)燃料电池能量转化率高,具有广阔的发展前景。天然气燃料电池中,在负极发生反应的物质是 ________(填化学式);如果该电池中的电解质溶液是KOH溶液,电极B电极上发生的电极反应式是:______________。
 。
。
【答案】 NH4+ 12 无色 Ag2S N2(g)+3H2(g)═ 2NH3(g)△H=﹣92.4kJ/mol 逆 不 0.15 mol/(Ls) CH4 O2+2H2O+4e- ═ 4OH-
【解析】分析:(1) ① NH4Cl属于强酸弱碱盐,根据盐类水解的规律分析解答;② NaOH溶液显碱性,先计算溶液中的c(OH-),再根据c(H+)=![]() 计算 c(H+),最后求pH;③盐酸滴定未知浓度的NaOH溶液,最终溶液显中性,根据酚酞作指示剂与溶液的性质分析解答;④首先根据Ksp计算判断两种沉淀的溶解度的大小,首先应该生成溶解度小的沉淀;
计算 c(H+),最后求pH;③盐酸滴定未知浓度的NaOH溶液,最终溶液显中性,根据酚酞作指示剂与溶液的性质分析解答;④首先根据Ksp计算判断两种沉淀的溶解度的大小,首先应该生成溶解度小的沉淀;
(2)① 根据热化学方程式的书写方法书写;② 根据温度和催化剂对化学平衡的影响分析解答;③ 可以首先计算前2s内v(NH3),再根据方程式有v(H2)=![]() v(NH3)计算v(H2);
v(NH3)计算v(H2);
(3)燃料电池中通入燃料的电极为负极,通入氧气或空气的电极为正极,在碱性电解质溶液中,不能大量存在氢离子,即电极方程式中不能生成氢离子。
详解:(1) ① 25℃时,NH4Cl溶液呈酸性,是因为氯化铵属于强酸弱碱盐,NH4+水解后溶液显酸性,故答案为:NH4+;
② 常温下,0.0100mol/L NaOH溶液中的c(OH-)=0.0100mol/L,c(H+)=![]() =
=![]() =1.0×10-12 mol/L,pH=-lg c(H+)=12,故答案为:12;
=1.0×10-12 mol/L,pH=-lg c(H+)=12,故答案为:12;
③ 用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为无色,且半分钟内颜色保持不变,故答案为:无色;
④ 25℃:AgCl(s) ![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s)
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,生成氯化银时c(Ag+)=
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,生成氯化银时c(Ag+)=![]() =
=![]() =1.8×10-7mol/L,生成硫化银时c(Ag+)=
=1.8×10-7mol/L,生成硫化银时c(Ag+)=![]() =
=![]() =8×10-23mol/L,因此先生成Ag2S沉淀,故答案为:Ag2S;
=8×10-23mol/L,因此先生成Ag2S沉淀,故答案为:Ag2S;
(2)① 25℃时,1mol N2完全转化为NH3时释放的能量为92.4 kJ,则热化学方程式为N2(g)+3H2(g)═ 2NH3(g)△H=﹣92.4kJ/mol,故答案为:N2(g)+3H2(g)═ 2NH3(g)△H=﹣92.4kJ/mol;
② 该反应为放热反应,升高温度平衡向逆反应方向移动;加入催化剂平衡不移动,故答案为:逆;不;
③ 前2s内v(NH3)=![]() =
=![]() =0.1 mol/(Ls),则v(H2)=
=0.1 mol/(Ls),则v(H2)=![]() v(NH3)=0.1 mol/(Ls)×
v(NH3)=0.1 mol/(Ls)×![]() =0.15 mol/(Ls),故答案为:0.15 mol/(Ls);
=0.15 mol/(Ls),故答案为:0.15 mol/(Ls);
(3)天然气燃料电池中,通入天然气的电极为负极;如果该电池中的电解质溶液是KOH溶液,电极B为正极,电极上发生的电极反应式为O2+2H2O+4e- ═ 4OH-,故答案为:CH4;O2+2H2O+4e- ═ 4OH-。

 小学教材全测系列答案
小学教材全测系列答案