题目内容
【题目】向一体积不变的密闭容器中充入![]() 和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中
和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中![]() 阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且
阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且![]() 各改变一种不同的条件。
各改变一种不同的条件。

(1)![]() 时改变的条件为___________,B的起始物质的量为____________。
时改变的条件为___________,B的起始物质的量为____________。
(2)各阶段平衡时对应的平衡常数如下表所示:
|
|
|
|
|
|
|
|
则![]() 之间的关系为___________。(用“>”、“<”或“=”)。
之间的关系为___________。(用“>”、“<”或“=”)。
(3)![]() 阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________。
阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________。
【答案】减小压强(或抽取出部分平衡混合气) ![]() K1=K2=K3<K4 2A(g)+B(g)3C(g)
K1=K2=K3<K4 2A(g)+B(g)3C(g) ![]()
【解析】
(1)t2-t3和t3-t4这两段平衡时不移动的,则只能是压强和催化剂影响的,因此应该推断该反应为等体积变化的反应,t2-t3的平衡比原平衡的速率要快,而t3-t4的速率又变慢,则前者应加入催化剂,因为条件只能使用一次,t3-t4段应为减压或取出部分平衡混合气体;反应物的浓度降低,生成物的浓度增大,结合图1可以知道,A为反应物,C为生成物,A的变化量为0.2mol/L,C的变化量为0.3mol/L。又因该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率比等于化学计量数比,该反应的方程式为2A(g)+B(g)![]() 3C(g),所以c(B)=
3C(g),所以c(B)=![]() c(A)=
c(A)=![]() mol/L=0.1mol/L,起始2molA所以对应浓度为1mol/L,则体积应为2L,故B的起始物质的量为n(B)=(0.1mol/L+0.4mol/L)
mol/L=0.1mol/L,起始2molA所以对应浓度为1mol/L,则体积应为2L,故B的起始物质的量为n(B)=(0.1mol/L+0.4mol/L)![]() 2L=1.0mol;
2L=1.0mol;
(2)t1-t2段,处于平衡状态,c(A)=0.8mol/L,c(B)=0.4mol/L,c(C)=0.6mol/L,K1=![]() =
=![]() =0.84;t2-t3段为使用催化剂,加快反应,平衡常数不变,K2=0.84;t3-t4段为降低压强,反应速率降低,平衡不移动,平衡常数不变,K3=0.84;t5-t6段,为升高温度,平衡向正反应方向移动,平衡常数增大,K4>0.84,故K1=K2=K3<K4;
=0.84;t2-t3段为使用催化剂,加快反应,平衡常数不变,K2=0.84;t3-t4段为降低压强,反应速率降低,平衡不移动,平衡常数不变,K3=0.84;t5-t6段,为升高温度,平衡向正反应方向移动,平衡常数增大,K4>0.84,故K1=K2=K3<K4;
(3)根据方程式计算,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,则反应2molA时,交换热量为200a kJ,而由图象可以知道,t4-t5阶段应为升高温度,正反应速率大于逆反应速率,平衡向正反应方向移动,则正反应应为吸热反应,所以热化学方程式为2A(g)+B(g)![]() 3C(g) H=+200a kJ/mol。
3C(g) H=+200a kJ/mol。

【题目】可用下面示意图表示的是
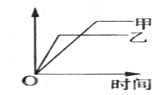
反应 | 纵坐标 | 甲 | 乙 | |
A | SO2与O2在同温、同体积容器中反应 | SO2的转化率 | 2molSO2和1molO2 | 2molSO2和2molO2 |
B | 2molSO2与1molO2在同温、体积可变的恒压容器中反应 | SO2的转化率 | 1×106Pa | 1×105Pa |
C | 相同质量氨,在同一固定容积容器中反应 | 氨气的浓度 | 400℃ | 500℃ |
D | 体积比为1:3的N2、H2在同温、体积可变的恒压容器中反应 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
A.AB.BC.CD.D