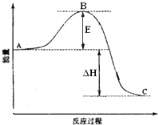
题目内容
【题目】下列依据热化学方程式得出的结论正确的是
A.已知2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1,则a>b
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH= -57.3 kJ·mol-1,则含1mol NaOH的稀溶液与足量稀醋酸完全中和,放出的热量等于57.3kJ
C.已知P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定
D.已知H2(g)+I2(g)![]() 2HI(g) ΔH= -a kJ·mol-1向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ
2HI(g) ΔH= -a kJ·mol-1向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ
【答案】D
【解析】
A.C燃烧反应是放热反应,物质燃烧时放出的热量越多,则该反应的反应热就越小。C完全燃烧产生CO2放出的热量比C不完全燃烧产生CO放出的热量多,所以反应热a<b,A错误;
B.醋酸电离过程吸收热量,所以含1mol NaOH的稀溶液与足量稀醋酸完全中和,放出的热量小于57.3 kJ,B错误;
C.物质含有的能量越低,物质的稳定性就越强;由于白磷转化为红磷放出热量,说明白磷的能量高,因此红磷比白磷稳定,C错误;
D.该反应是可逆反应,反应物不能完全转化为生成物,所以向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ,D正确;
故合理选项是D。

【题目】向一体积不变的密闭容器中充入![]() 和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中
和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中![]() 阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且
阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且![]() 各改变一种不同的条件。
各改变一种不同的条件。

(1)![]() 时改变的条件为___________,B的起始物质的量为____________。
时改变的条件为___________,B的起始物质的量为____________。
(2)各阶段平衡时对应的平衡常数如下表所示:
|
|
|
|
|
|
|
|
则![]() 之间的关系为___________。(用“>”、“<”或“=”)。
之间的关系为___________。(用“>”、“<”或“=”)。
(3)![]() 阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________。
阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________。