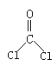
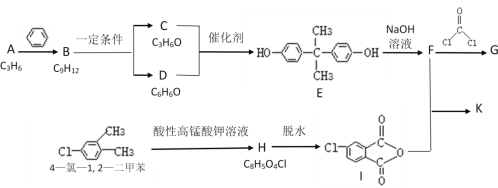
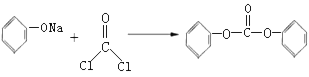
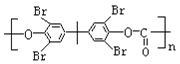
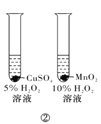
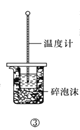
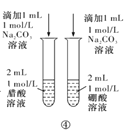
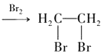题目内容
【题目】CO常用于工业冶炼金属。在不同温度下CO还原四种金属氧化物达平衡后气体中![]() 与温度
与温度![]() 的关系曲线如图。下列说法正确的是
的关系曲线如图。下列说法正确的是
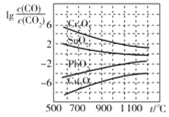
A.通过增高反应炉的高度,增大矿石和CO接触面积,能减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属Cr
C.CO还原![]() 的反应
的反应![]()
D.工业冶炼金属Cu时,高温有利于提高CO的转化率
【答案】B
【解析】
A.增高反应炉的高度,增大CO与铁矿石的接触面积,不能影响平衡移动,CO的利用率不变,故A错误;
B.由图象可知用CO冶炼金属Cr时,![]() 值很高,说明CO转化率很低,不适合,故B正确;
值很高,说明CO转化率很低,不适合,故B正确;
C.由图象可知CO还原![]() 的温度越高,
的温度越高,![]() 越高,说明CO转化率越低,平衡逆向移动,故
越高,说明CO转化率越低,平衡逆向移动,故![]() ,故C错误;
,故C错误;
D.由图象可知用CO冶炼金属Cu时,温度越高,![]() 越大,故CO转化率越低,故D错误;
越大,故CO转化率越低,故D错误;
故选:B。

【题目】Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第____周期第____族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为__________。
(2)用“>”或“<”填空:
第一电离能 | 离子半径 | 熔点 | 酸性 |
Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
【题目】向一体积不变的密闭容器中充入![]() 和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中
和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中![]() 阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且
阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且![]() 各改变一种不同的条件。
各改变一种不同的条件。

(1)![]() 时改变的条件为___________,B的起始物质的量为____________。
时改变的条件为___________,B的起始物质的量为____________。
(2)各阶段平衡时对应的平衡常数如下表所示:
|
|
|
|
|
|
|
|
则![]() 之间的关系为___________。(用“>”、“<”或“=”)。
之间的关系为___________。(用“>”、“<”或“=”)。
(3)![]() 阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________。
阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________。