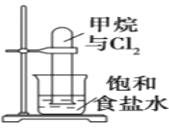
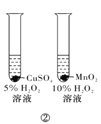
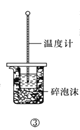
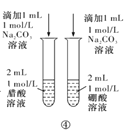
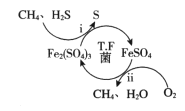
题目内容
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
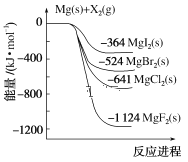
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.金属镁和卤素单质(X2)的反应都是放热反应
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
【答案】C
【解析】
A.依据图象分析判断,Mg与Cl2的能量高于MgCl2,依据能量守恒判断,所以由MgCl2制取Mg是吸热反应,A错误;
B.物质的能量越低越稳定,由图象数据分析,化合物的热稳定性顺序为:MgI2<MgBr2<MgCl2<MgF2,B错误;
C.由图可知均为反应物总能量大于生成物总能量,因此反应都是放热反应,C正确;
D.依据图象Mg(s)+Cl2(l)=MgCl2(s)△H=-641kJ/mol,Mg(s)+Br2(l)=MgBr2(s)△H=-524kJ/mol,将第一个方程式减去第二方程式得MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g)△H=-117kJ/mol,D错误;
故合理选项是C。

【题目】向一体积不变的密闭容器中充入![]() 和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中
和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中![]() 阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且
阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且![]() 各改变一种不同的条件。
各改变一种不同的条件。

(1)![]() 时改变的条件为___________,B的起始物质的量为____________。
时改变的条件为___________,B的起始物质的量为____________。
(2)各阶段平衡时对应的平衡常数如下表所示:
|
|
|
|
|
|
|
|
则![]() 之间的关系为___________。(用“>”、“<”或“=”)。
之间的关系为___________。(用“>”、“<”或“=”)。
(3)![]() 阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________。
阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________。